微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈______
(2)MnO2加入双氧水中反应更剧烈______
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完______
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生______
(5)光照下甲烷与氯气反应,而在黑暗处两者不反应______.
参考答案:(1)因增大反应物浓度,加快化学反应速率,所以硫在纯氧中燃烧
本题解析:
本题难度:一般
2、选择题 在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
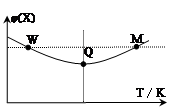
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
参考答案:C
本题解析:
试题分析:A、分析图像,X的体积分数先减小后增大,减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,体积分数增大,说明升高温度,平衡向左移动,使平衡常数减小,故A错误; B、M点温度高,故反应速率快,B错误;从开始到Q点是正向建立平衡的过程,转化率逐渐增大,从Q到M点升高温度,平衡向左移动,使转化率降低,Q点最大,故C正确;平衡时再充入Z,达到的新平衡与原平衡是等效平衡,体积分数相等,故D错误;故选C。
本题难度:一般
3、计算题 已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号
| 往烧杯中加入的试剂及其用量(mL)
| 催化剂
| 开始变蓝时间(min)
|
0.1 mol·Lˉ1
KI溶液
| H2O
| 0.01 mol·Lˉ1
X溶液
| 0.1 mol·Lˉ1
双氧水
| 1?mol·Lˉ1
稀盐酸
|
1
| 20.0
| 10.0
| 10.0
| 20.0
| 20.0
| 无
| 1.4
|
2
| 20.0
| m
| 10.0
| 10.0
| n
| 无
| 2.8
|
3
| 10.0
| 20.0
| 10.0
| 20.0
| 20.0
| 无
| 2.8
|
4
| 20.0
| 10.0
| 10.0
| 20.0
| 20.0
| 5滴Fe2(SO4)3
| 0.6
|
?
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m=????????????,n=??????????????。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。
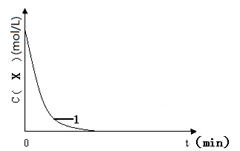
(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂??????(填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)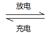 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
参考答案:(16分)??
(1)20.0,20.0??(各2分,
本题解析:
试题分析:(1)根据对比实验的目的可知,只改变双氧水浓度,其它条件相同,则盐酸的浓度不变,所以其体积保持不变,则n=20.0;由于实验1所用溶液总体积为(20.0+10.0+10.0+20.0+20.0)mL,实验2所用溶液的总体积为(20.0+m+10.0+10.0+n),由于实验1、2所用溶液的总体积相同,n=20.0,则m=20.0;(2)由于n=c?V,则n(X)= 0.01 mol·Lˉ1×10.0×10ˉ3L =10ˉ4mol;由于I2与X反应时,两者物质的量之比为1∶2,则n(I2)
本题难度:困难
4、选择题 实验室可用下图装置(启普发生器)制取氢气。欲使得到氢气的速率加快,下列措施可行的是???
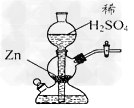 [???? ]
[???? ]
A.将10%的稀硫酸改用98%的浓硫酸
B.将10%稀盐酸改用4.4mol/L(ρ=1.073)的稀盐酸
C.向稀硫酸中加入Cu(NO3)2溶液
D.给装置中发生反应的部分加热
参考答案:B
本题解析:
本题难度:一般
5、选择题 某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)
2Q(g)
平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q(相当加压),则下列叙述正确的是
A.刚充入时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的体积分数增加
C. 达到新的平衡时:c(A):c(B):c(Q)仍为1:1:2
D. 达到新的平衡过程中:体系压强先增大,后减小
参考答案:D
本题解析:
试题分析:A、刚充入时相当于增大压强,正逆反应的速率都增大,错误;B、增大压强,平衡正向移动,A、B的体积分数减小,错误;C、由于平衡发生了移动,所以再达平衡时各物质的物质的量浓度之比发生变化,不是1:1:2,错误;D、刚充入时体系的压强增大,随着反应的正向进行,是体系的压强逐渐减小,所以压强是先增大后减小,正确,答案选D。
考点:考查化学平衡移动的判断,反应速率的变化与条件改变的关系
本题难度:一般