微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组实验中,过氧化氢分解最快的是( )
| ? | H2O2的浓度 | 温度(℃) | 催化剂
A
5%
5
使用MnO2
B
8%
5
不使用
C
10%
40
使用MnO2
D
10%
40
不使用
A.A
B.B
C.C
D.D
参考答案:根据反应速率的影响因素:温度越高、浓度越大、使用催化剂都有利
本题解析:
本题难度:简单
2、选择题 下列过程中,需要加快化学反应速度的是( )
A.钢铁腐蚀
B.食物变质
C.金属冶炼
D.塑料老化
参考答案:为避免材料的浪费和资源的损耗,钢铁腐蚀、食物变质以及塑料老化
本题解析:
本题难度:一般
3、实验题 (8分)某化学反应2A (g)  ?B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表: ?B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
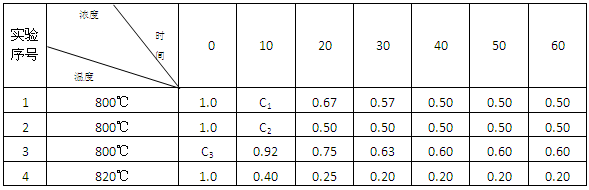
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是???????min,实验4达到平衡的时间是???????min.
(2)C1??????????????C2(填“大于”“小于” “等于”);C3= ????????????mol?L-1
(3)实验4比实验1的反应速率?????(填“快”或“慢”),原因是????????????????
(4)如果2A (g)  ?B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,?????放出的热量多,理由是??????????。 ?B(g) + D(g) 是一个放热反应,那么实验4与实验1相比,?????放出的热量多,理由是??????????。
参考答案:(1)40???? 30??(2)大??大于1.0
(
本题解析:(1)当反应达到平衡状态后,各种物质的浓度和含量将不再发生变化。根据表中数据可知实验1和实验4在分别反应进行到40min和30min时A的浓度就不再随时间变化而变化,这说明反应已经达到化学平衡状态。
(2)实验1和实验2相比温度相同,起始浓度相同,到达平衡时A的浓度也相同,但到达平衡的时间是实验2用时少,这说明实验2的反应速率大,进行的快,因此1.0-C1<1.0-C2,所以C1>C2。因为随着反应的进行,A的浓度逐渐减小,所以反应速率会逐渐减小,即C3-0.92mol/L>0.92mol/L-0.
本题难度:一般
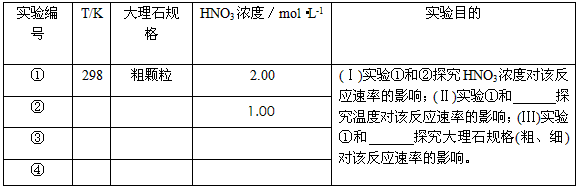
4、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
(2)实验①中CO2质量随时间变化的关系见下图
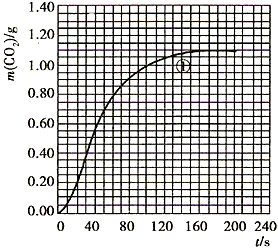
依据反应方程式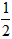 CaCO3+HNO3== CaCO3+HNO3== Ca(NO3)2+ Ca(NO3)2+ CO2↑+ CO2↑+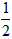 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:困难
5、选择题 已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,;一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液
D.将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI
参考答案:C
本题解析:略
本题难度:简单
|