微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 普通干电池负极的电极反应式是( )
A.Zn-2e-=Zn2+
B.Zn2++2e-=Zn
C.4OH--4e-=O2↑+2H2O
D.2H++2e-=H2↑
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (10分)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
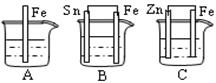
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的pH值 (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是 ,该电极电极反应式为 ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 。
参考答案:(1)Fe+2H+==Fe2++H2;(2分)
(2)
本题解析:
试题分析:(1)铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+==Fe2++H2;(2)B中铁做原电池的负极,锡做原电池的正极,氢离子在正极反应变成氢气,电极反应为:2H+-2e-==H2;所以溶液中pH变大;(3)C中锌做原电池的负极,被腐蚀,电极反应为Zn-2e-==Zn2+;在三个装置中铁在B中腐蚀最快,在C中腐蚀最慢,所以腐蚀的快慢顺序为:BAC。
考点:原电池的原理的应用。
本题难度:一般
3、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
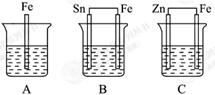
(1) A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 。Sn极附近溶液的c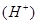 (填 “变大”“变小”或“不变”)。
(填 “变大”“变小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应的化学方程式为
,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填序号)。
参考答案:(12分,每空2分)(1)Fe + 2H+= Fe + H2
本题解析:
试题分析:(1)装置A中铁直接与稀硫酸发生置换反应,反应的离子方程式是Fe + 2H+= Fe + H2↑。
(2)装置B中铁的金属性强于Sn的,则铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,电极反应式是2H+ + 2e-=H2↑,所以正极周围溶液中氢离子浓度变小。
(3)装置C中锌的金属性强于铁的,锌失去电子,做负极,被腐蚀。铁是正极,被保护,总的方程式是Zn + H2SO4= ZnSO4 + H2↑。根据以上分析可知,A、B、C中铁被腐蚀的速率,由快到慢的顺序为B>A>C。
考点:考查原电池的有关应用、金属的腐蚀与防护
点评:该题是基础性试题的考查,也是高考中的重要考点。主要是考查学生对原电池原理以及金属腐蚀与防护的熟悉了解程度,意在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 下列反应中,在原理上可以设计成原电池的是[???? ]
A.Ba(OH)2·8H2O与NH4Cl的反应
B.铝片与盐酸的反应
C.甲烷与氧气的反应
D.石灰石的分解反应
参考答案:BC
本题解析:
本题难度:简单
5、选择题 有关下图的说法不正确的是
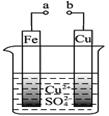
A.构成原电池时Cu极反应为: Cu
参考答案:
本题解析:
本题难度:一般