微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
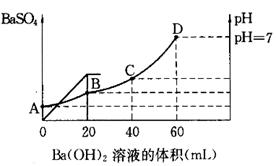
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
参考答案:(1)0.05mol/L (2)0.2mol/L&
本题解析:
试题分析:(1)根据图像可知,当加入20ml氢氧化钡时,沉淀达到最大值,所以硫酸的物质的量是0.02L×0.05mol/L=0.001mol,则硫酸的浓度是0.001mol÷0.02L=0.05mol/L。
(2)当Ph=7是,酸碱恰好中和,则盐酸的物质的量是2×0.04L×0.05mol/L=0.004mol,则盐酸的浓度是0.004mol÷0.02L=0.2mol/L。
(3)B点相当于是硫酸被中和,则溶液中氢离子的浓度是 ,所以pH=1。
,所以pH=1。
考点:考查酸碱中和的有关判断以及pH的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确图像的变化趋势特点,然后结合题意灵活运用即可。
本题难度:一般
2、填空题 (8分)下表是不同温度下水的离子积常数:
温度/℃
| 25
| t1
| t2
|
水的离子积常数
| 1×10-14
| a
| 1×10-12
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”),做此判断的理是 。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= ;此溶液中各种离子的浓度由小到大的顺序是 。
参考答案:(1)> 水的电离程度增大,所以水的离子积增大
本题解析:
试题分析:(1)因为25℃时,Kww=1×10-14,t2℃,Kww=1×10-12,因为25<t1<t2,所以t1℃时,则1×10-12>a>1×10-14,这是因为温度升高,平衡向水电离的方向移动,水的电离程度增大,所以水的离子积增大。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L ,则该Na2SO4溶液中c(Na+)=1×10-3,稀释10倍后为1×10-4mol/L,c(OH-)=1×10-7mol/L,所以c(Na+)∶c(OH-)=1000,
(3) t2℃时, Kww=1×10-12,PH=11的NaOH溶液,C(OH-)="0.1mol/L," pH=1的稀硫酸溶液,C(H+)=0.1mol/L,酸、碱混合后溶液的PH=2,混合溶液呈酸性,所以[(0.1×V2)-(0.1×V1)]÷(V2+V1)=10-2,整理得V1:V2=9:11,该溶液为硫酸钠和硫酸的混合溶液,所以此溶液中各种离子的浓度由小到大的顺序是c(OH-)<c(H+)<c(SO42-)<c(Na+)。
考点:考查水的电离平衡及影响因素。
本题难度:一般
3、选择题 实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g 样品,溶于水配成250 .00 ml溶液,取出该溶液25.00 ml用 0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是

A.上一个计量点前发生反应的离子方程式为HCO3-+H+===H2O+CO2↑
B.下一个计量点溶液中存在大量的阴离子是Cl-、HCO3-
C.此样品n(NaHCO3)=" (28.1" - 2×11.9)×10-4 mol
D.使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
参考答案:C
本题解析:
试题分析:A、向碳酸钠和碳酸氢钠的混合液中滴加盐酸首先与碳酸钠反应生成碳酸氢钠,则上一个计量点前发生反应的离子方程式为CO32-+H+=HCO3-,A错误;B、下一个计量点溶液显酸性,碳酸氢根离子已经全部转化为CO2,B错误;C、碳酸钠转化为碳酸氢钠,以及生成的碳酸氢钠与盐酸反应转化为CO2时消耗的盐酸是相等的,则根据图像可知此样品n(NaHCO3)=(28.1ml-2×11.9ml)×10-3L/ml×0.1mol/L=(28.1- 2×11.9)×10-4 mol,C正确;D、向Na2CO3和NaOH混合溶液中滴加盐酸首先发生中和反应,然后与碳酸钠反应生成碳酸氢钠,最后再与碳酸氢钠反应生成CO2,所以使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,不会得到1个计量点,D错误,答案选C。
考点:考查物质含量测定实验设计与探究
本题难度:一般
4、选择题 下列说法正确的是( ) A.水的离子积常数KW随温度改变而改变,随外加酸碱浓度改变而改变
B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大
C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列各物质投入水中,因促进水的电离而使溶液呈碱性的是
A.NaOH
B.NH3
C.CH3COONa
D.NH4Cl
参考答案:C
本题解析:
试题分析:酸碱抑制水的电离,能水解的盐促进水的电离,CH3COONa属于强碱弱酸盐,水解显碱性,NH4Cl属于强酸弱碱盐,水解显酸性,选C。
考点:考查影响水电离的因素。
本题难度:一般
|