微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)在2L的密闭容器中,加入2molA和1molB,发生以下反应:
2A(g)+B(g) ≒? 2C(g)+D(s)
达到平衡时,C的浓度为0.4mol/L。
(1)温度不变,若缩小容积体积,则平衡?????????移动(填正向、逆向、不)。
(2)维持容器的温度和体积不变,按下列四种配比作起始物质,达平衡后,C的浓度仍是0.4mol/L是?????????????。
A.4molA+2molB
B.2molC+2molD
C.2molA+1molB+2molC+1molD
D.1molA+0.5molB+1molC+0.5molD
(3)若维持容器的温度和体积不变,按不同配比加入起始物质,达平衡后,C的浓度仍是0.4mol/L。
①反应从逆反应方向开始,则D的起始物质的量应满足的条件是???????????????(用数学关系式回答,下同)。
②若加入0.2molA和0.1molB,则C和D起始物质的量分别应满足???????????,???????????。
参考答案:(1)正向????(2)BD???
(3)① n(D)
本题解析:(1)加压向气体体积缩小的方向移动,即此反应的正反应方向;(2)等温等容条件下的等效平衡,一边倒,反应物的物质的量要相等,故答案为BD;(3)①反应从逆反应方向开始,达平衡后,C的浓度仍是0.4mol/L,则平衡时A、B的浓度为0.6 mol/L、0.3 mol/L,即n(B)="0.6" mol,故需要n(D)=0.6mol来转化,又因为D是固体,增加量,平衡不移动,所以n(D)>0.6mol②n(C)+0.2mol= n(A)=2mol,故n(C)=1.8mol;平衡时n(B)="0.6" mo
本题难度:一般
2、选择题 物质的量浓度相同的NaCl MgCl2 AlCl3三种溶液,当溶液的体积比为3:2:1时,三种溶液中Cl-的物质的量浓度之比为
A.1:1:1
B.1:2:3
C.3:2:1
D.3:4:3
参考答案:B
本题解析:物质的量浓度相同的NaCl 、MgCl2、AlCl3三种溶液中氯离子的浓度之比是1:2:3,答案选B。
本题难度:简单
3、选择题 下列说法中正确的是(NA为阿伏加德罗常数)????????(???)
A.78 gNa2O2晶体中所含阴阳离子个数均为2NA
B.1.5 g CH3+中含有的电子数为NA
C.3.4 g氨气分子中含有0.6NA个N—H键
D.常温下,100 mL1 mol·L-1AlCl3溶液中Al3+离子总数等于0.1NA
参考答案:C
本题解析:A错,Na2O2晶体是由Na+、O22—离子构成,阳离子与阴离子个数比为2:1,78 gNa2O2晶体中所含阳离子个数均为2NA,阴离子个数为NA;B错,1.5 g CH3+中含有的电子数为0.8NA;
C正确,.3.4 g氨气分子中含有0.6NA个N—H键;D错,常温下,100 mL1 mol·L-1AlCl3溶液中Al3+离子总数小于0.1NA
本题难度:一般
4、填空题 用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4,请按要求填空:
(1)所需浓H2SO4的体积为______
(2)实验室除用到量筒、烧杯、玻璃棒外,实验中还需要用到的仪器有______.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容______.
②定容时俯视刻度线______.
(4)若定容时液面高于刻度线应采取的措施是______.
参考答案:(1)浓H2SO4的物质的量浓度c=
本题解析:
本题难度:简单
5、选择题 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸的物质的量浓度为9.2 mol/L
B.若该硫酸与等体积的水混合,所得溶液的质量分数小于49%
C.若实验室需要4.6 mol/L的稀硫酸480 mL,则应用量筒量取该硫酸125.0mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L
参考答案:C
本题解析:根据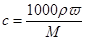 可知,硫酸的浓度是
可知,硫酸的浓度是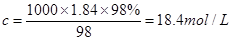 ,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分
,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分
本题难度:一般