微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知使用林德拉催化剂(Pd/PbO、CaCO3,其中钯附于碳酸钙及少量氧化铅上)可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示的仪器组装而成的实验装置(铁架台未画出),由乙炔制得乙烯,并测定在氢化反应中乙炔的转化率。若用含0.020 mol CaC2的电石和含1.30g锌的锌粒(杂质不与酸反应)分别与足量的饱和食盐水和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水的体积为V mL(忽略乙炔在水中溶解的部分)。试回答下列问题:
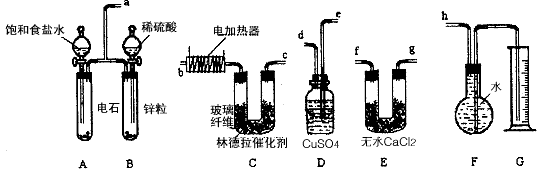
(1)各装置的连接顺序为a→_____ →_____→_____→ _____→_____ → _____→h。
(2)写出C中所发生的两个反应的化学方程式:__________ 。
(3)装置A中产生气体的反应速率往往太快,为了减慢反应速率,操作时还应采取的措施是________。
(4)装置D的作用______________ 。
(5)G所选用的量筒的容积较合理的是_________ (填写选项字母)。
A. 500mL
B. 1000mL
C. 2000mL
(6)若V=672(导管内气体体积忽略不计),则乙炔的转化率为___________。
参考答案:(1)e→d→f→g→b→c或e→d→g→f→b→c
本题解析:
本题难度:一般
2、填空题 氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
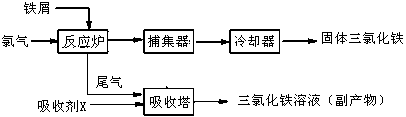
无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为:________________________ 。
(2)已知六水合氯化铁在水中的溶解度如下:
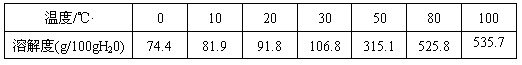
从FeCl3溶液中获得FeCl3·6H2O的方法是:_________________ 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:___________
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= ______________mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)吸收剂X是: ____________;吸收塔中吸收剂X的作用是:_____________________ 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol/LNa2S2O3溶液滴定,反应方程式为:I2+2S2O32-=2I-+S4O62-,共用去VmL。则样品中氯化铁的质量分数为:______________。
参考答案:(1)Fe3++3H2O![]() 本题解析:
本题解析:
本题难度:一般
3、实验题 某化学兴趣小组用如下装置模拟工业制备造纸原料BaSO3,并测定产品纯度。
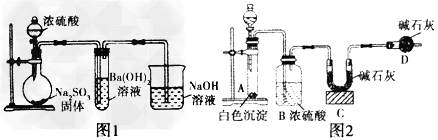
(1)图1烧瓶中发生反应的化学方程式为______________________________
(2)甲同学观察到图1试管中出现白色沉淀,该白色沉淀可能含有①BaSO3;②_________________________
(3)为探究白色沉淀的成分设计如下实验方案:

(4)为测定产品纯度取白色沉淀wg于图2装置的试管,在分液漏斗中加入____________(可从稀盐酸、稀硝酸、稀NaOH溶液中选择一种)。实验后,测得C装置增重mg,根据此实验数据可计算出白色沉淀中BaSO3的质量分数为__________(用含m、w的式子表示)。本测定方案有缺陷,请指出本方案的缺点及其对实验结果的可能影响 ________________________________________________
(5)为制备纯净的BaSO3,请设计改进图1装置的实验方案____________________。
参考答案:(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑
本题解析:
本题难度:一般
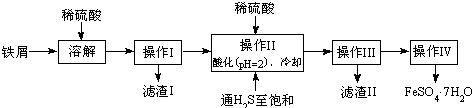
4、简答题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值
饱和H2S溶液
3.9
SnS沉淀完全
1.6
FeS开始沉淀
3.0
FeS沉淀完全
5.5
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为______.
A.KSCN溶液?????B.NaOH溶液????C.KMnO4溶液?????D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是______;在溶液中用硫酸酸化至pH=2的目的是______.
(3)操作IV的顺序依次为______、冷却结晶、______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______(填仪器名称).
②判断此滴定实验达到终点的方法是______.
③计算上述样品中FeSO4?7H2O的质量分数为______.
参考答案:(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价
本题解析:
本题难度:一般
5、推断题 实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
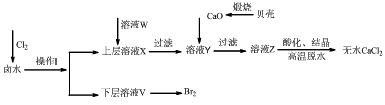
(1)操作I使用的试剂是_______________,用主要仪器的名称是_____________。
(2)加入溶液W的目的是___________________,用CaO调节溶液Y的pH,可以除去Mg。由表中数据可知,理论上可选择的pH最大范围是___________。酸化溶液Z时,使用的试剂为_____________。
(3)实验室用贝壳与稀盐酸反应制备并收集CO气体,下列装置中合理的是_____________________。
a.
b.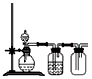
c.
d.
(4)常温下,H2SO3的电离常数K=1.2×10-2,,K=6.3×10-3;H2CO3的电离常数K=4.5×10-7,K=4.7×10-11某同学设计实验验证H2SO3酸性强于H2CO3;将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,H2SO3酸性强于H2CO3,该实验设计不正确,错误在于_____________________。设计合理试验验证H2SO3酸性强于H2CO3(简要说明试验步骤、现象和结论)______________________________________。仪器自选。供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
参考答案:(1)四氯化碳;分液漏斗
(2)除去溶液中的SO42-
本题解析:
本题难度:一般
|