微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度不再变化
C.单位时间内生成,n?mol?A,同时生成3n?mol B
D.A、B、C的分子数之比为l:3:2
参考答案:A、同一种物质的生成速率与分解速率相等是平衡状态,故A正确;
本题解析:
本题难度:一般
2、填空题 硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI H2↑+I2
H2↑+I2
Ⅲ.2H2SO4=2SO2+O2↑+2H2O
(1)分析上述反应,下列判断正确的是?????????。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时间的变化如图所示。
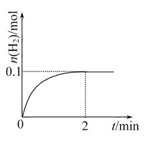
①0~2 min内的平均反应速率v(HI)=??????????。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则???????是原来的2倍。
a.HI的平衡浓度
b.达到平衡的时间
c.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列固体试剂中的?????,产生H2的速率将增大。
a.NaNO3?????????b.CuSO4????????c.Na2SO4????????d.NaHSO3
参考答案:(1)c?? (2)①0.1 mol·L-1·min-1?②
本题解析:(1)根据题意可知,因为是分解水制取H2的反应,所以应不断补充水,产生2 mol H2时,生成1 mol O2,c对、d错;硫酸常温不分解,a错;反应Ⅰ中SO2为还原剂,HI为还原产物,还原性SO2>HI,b错。
(2)①2 min时H2的平衡浓度为0.1 mol·L-1,H2的平均反应速率为
0.1 mol·L-1/2 min="0.05" mol·L-1·min-1,v(HI)=2v(H2)="0.05" mol·L-1·min-1×2="0.1" mol·L-1·min-1。
本题难度:一般
3、填空题 煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 800
|
平衡常数K
| 9.94
| 9
| 1
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有????(选填A、B、C、D、E);
?
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
| A
| 1
| 5
| 2
| 3
| B
| 2
| 2
| 1
| 1
| C
| 3
| 3
| 0
| 0
| D
| 0.5
| 2
| 1
| 1
| E
| 3
| 1
| 2
| 1
(2)在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为??????????????。
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;K的表达式?????????????; 2CO(g)平衡常数K;K的表达式?????????????;
C(s)+H2O(g) CO(g)+H2(g)?平衡常数K1; CO(g)+H2(g)?平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2; H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是:? ;
(4)某温度下C(s)+CO2(g) 2CO(g)能判断该反应达到化学平衡状态的依据是________。 2CO(g)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO)??????????? B.K不变??????????????? C.容器中的压强不变
D.v正(CO)=2v正(CO2)???????E.c(CO)保持不变???????? F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1molC和1molCO2,并使甲、乙两容器初始容积相等。在相同温度下发生反应C(s)+CO2(g) 2CO(g),并维持反应过程中温度不变。已知甲容器中 2CO(g),并维持反应过程中温度不变。已知甲容器中
CO2的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图像。
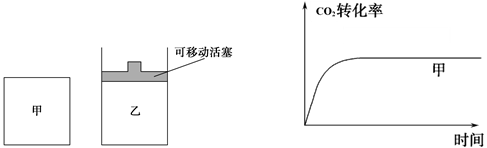
图1???????????????????????????????????????图2
参考答案:
(1)BCE????????????????????
本题解析:
试题分析:(1)先求各个情况下的生成物浓度幂之积与反应浓度幂之积的比:Q(A)=1.2;Q(B)=0.25;Q(D)=1;Q(E)=0.67;可以看出只有BCE向正反应方向移动,而A是逆向移动,D已达到平衡状态。
CO(g)+H2O(g)  H2(g)+CO2(g) H2(g)+CO2(g)
起始: 10mol???
本题难度:困难
4、填空题 (1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2?的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
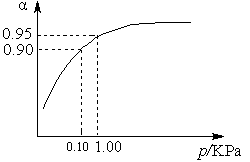
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g)??ΔH ="-98.3" kJ·mol-1。 2SO3(g)??ΔH ="-98.3" kJ·mol-1。
容?器
| 甲
| 乙
| 丙
| 反应物投入量
| 2 mol SO2、1 mol O2
| 2 mol SO3
| m mol SO2、n mol O2、
p mol SO3
| c(SO3) /mol·L-1
| 1.4
| 1.4
| 1.4
| 能量变化
| 放出a kJ
| 吸收b kJ
| 吸收c kJ
| SO2或SO3的转化率
| α1
| α2
| 12.5%
?
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
参考答案:(1)SO2+V2O5 本题解析:(1)根据反应物和生成物可知,方程式为SO2+V2O5 本题解析:(1)根据反应物和生成物可知,方程式为SO2+V2O5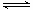 SO3+ V2O4。 SO3+ V2O4。
(2)SO2和碘反应的方程式为SO2+I2+2H2O=H2SO4+2HI,所以SO2的物质的量是0.0500 mol/L×0.01L=0.0005mol,其体积是0.0005mol×22.4L/mol=0.0112L,所以烟气中S
本题难度:一般
5、填空题 t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3 A(g)+B(g)  ?xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白: ?xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为?????????????????????;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) (?)
A.向正反应方向移动???? B.向逆反应方向移动???? C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=???????????mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为?????????????????????。
参考答案:(9分)(1) 0.2mol/L.min? (2) 4
本题解析:
试题分析:(1)2min达平衡时,容器中剩余0.8molB,则消耗0.2molB,c(C)=0.4mol?L-1,v(C)="0.4(mol/L)/2(min)" =0.2mol?L-1?min-1,
(2)v(B)=(0.2mol/2L)/2min=0.05mol?L-1?min-1,由化学反应速率之比等于化学计量数之比,则v(B)/v(C)=1/x,解得x=4,故答案为:0.2mol/Lmin;4;
(4)向原平衡混合物的容器中再充入amolC,在T℃达到新的平衡与原平衡等效,<
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772