微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
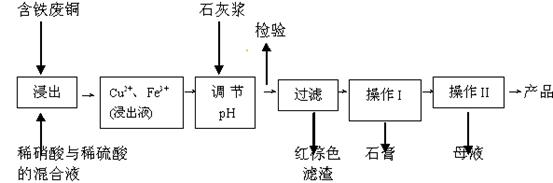
1、填空题 (11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(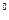 C) C)
| 20
| 40
| 60
| 80
| 100
|
石膏
| 0.32
| 0.26
| 0.15
| 0.11
| 0.07
|
胆矾
| 32
| 44.6
| 61.8
| 83.8
| 114
请回答下列问题:
(1)红棕色滤渣的主要成分是???????????;
(2)写出浸出过程中生成硫酸铜的离子方程式?????????????????????????;
(3)操作I包括蒸发浓缩、????等操作,温度应该控制在????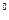 C左右; C左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为?????、????、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是????;干燥时采用晾干,不用加热烘干的原因是???????????????????????????。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;??方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是?????????;
②指出你认为不合理方案存在的问题是??????????。
参考答案:(1)Fe(OH)3
(2)3Cu+8H++2NO3—
本题解析:略
本题难度:简单
2、选择题 钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为??????????;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为????????????????????????????。
II.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
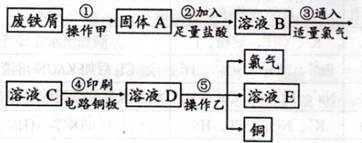
请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为????????????。
(2)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是(???)
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①②
B.②⑨
C.⑨④
D.①④
(3)步骤⑤产生金属铜的化学方程式为??????????????????????。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的l/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为??????????????????????????????????????,若此过程中共生成了8 gFe2O3,则转移的电子的物质的量为?????????????。
参考答案:(共16分)
I.Fe3O4(2分)??? 3Fe+4
本题解析:
试题分析:
I.考查课本基础知识,可以直接作答;
II.(1)从题意中Fe中含有Fe2O3,故可以得到后面反应
(2)Fe2+的检验要考虑Fe3+的干扰,故先加KSCN无明显现象,后氧化后变红或加入NaOH开始只产生白色沉淀。
(3)D溶液中有Fe2+、Cu2+、Cl+等,反应后生成了Cu和氯气,故该反应为电解反应。
Ⅲ.吸氧反应中吸收氧气生成氢氧根。
本题难度:一般
3、计算题 把12.6g的镁铝合金的粉末放入过量盐酸中,得到13.44L气体(标况下)。试计算:
(1)该合金中铝的质量分数
(2)该合金中镁和铝的物质的量之比
参考答案:(1)W(Al) = 42.9%
(2)n(Mg):
本题解析:设合金中镁和铝的物质的量分别为X mol,Y mol,
n(H2)=" 13.44/22.4" =" 0.6" mol
Mg+2H+===Mg2++H2↑
1 mol 1 mol
X mol Xmol
2Al+6H+===2Al3++3H2↑
2 mol ? 3 mol
Y mol 1.5 Y mol
 本题难度:简单 本题难度:简单
4、填空题 (1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是???????。发生反应的离子方程式为???????????????????;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为????????????????。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
步骤
| 操作
| 现象及结论
| 1
| 用甲、乙两支试管分别取两种溶液各少许。
| ?
| 2
| 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。
| ?
| 3
| ?????????????????????????????????。
| ??????????????,则甲是????,乙是???。
??????????????,则甲是???,乙是???。
?
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
参考答案:(12分)
(1)Fe2+、Cu2+???????Fe
本题解析:
试题分析:(1)氯化铁溶液能氧化铜,为了使之完全溶解,氯化铁溶液可能过量;由于Cu+2Fe3+=2Fe2++Cu2+,则溶解铜后的溶液中一定含有的金属阳离子为Fe2+、Cu2+,可能有的是Fe3+;由于氧化性:Fe3+ >Cu2+>Fe2+,则加入一定量的铁粉时,先发生的反应为2Fe3+ + Fe= 3Fe2+,铁离子被还原后,过量的铁粉还能再发生反应Fe+ Cu2+= Fe2+ + Cu,由于a>b>c,说明最终溶液中金属阳离子一定含有Fe2+、Cu2+,因此滤渣中肯定没
本题难度:一般
5、实验题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
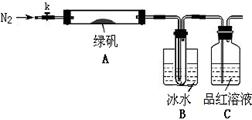
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
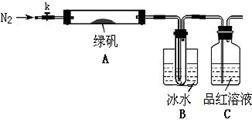
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是??????????????????;
结论2:C中溶液褪色,可推知产物中有???????????????????;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:???????????????????????????。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是??????????。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
参考答案:(1)除油污;
(2)应该铁屑过量(或反应后溶液中必须
本题解析:
试题分析:(1)碳酸钠溶液与废铁屑的成分均不能反应,故只起去油污的作用;(2)结合废铁屑的成分和后边的步骤可知,必须保证铁有剩余,才能保证溶液中没有铁离子;(3)降低温度,减小绿矾的溶解度;(4)硫酸亚铁晶体受热有水蒸汽生成,根据三氧化硫的熔点可知,冰水能将三氧化硫和水液化,在B中反应生成硫酸;C中是生成的二氧化硫使品红溶液褪色;(5)二氧化硫要进行尾气处理;(6)固体中有氧化铁,溶于盐酸后有三价铁生成,要想检验二价铁的存在,需利用亚铁离子的还原性,使酸性高锰酸钾溶液褪色,故选b。
本题难度:困难
|
|