微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
[???? ]
A.任何反应中的能量变化都表现为热量变化
B.物质发生化学变化都伴随着能量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列说法不正确的是
A.所有放热反应的发生都无需任何条件
B.化学变化中都伴有能量变化
C.电解水生成氢气和氧气时,电能转化为化学能
D.在一个确定的化学反应体系中,反应物的总能量可能高于生成物的总能量。
参考答案:A
本题解析:略
本题难度:简单
3、选择题 已知某反应的能量变化如图所示,下列说法正确的是

A.该反应可用于表示烧碱与硫酸反应
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.该反应可用于表示碳酸钙受热分解的反应
参考答案:D
本题解析:
试题分析:由图可知:反应物的能量低,生成物的能量高,由反应物发生反应变为生成物时要从环境中吸收热量。该反应为吸热反应。A.烧碱与硫酸反应是放热反应。错误。B.该反应只有在一定条件下发生,但是反应不移动要在加热条件下。错误。C.反应物的总能量低于生成物的总能量。错误。D.碳酸钙受热分解的反应是吸热反应,因此改图可表示这一反应。正确。
本题难度:一般
4、选择题 已知:2SO2(g)+O2(g) 2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 ?
2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 ?
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ此时有2 mol SO2(g)被氧化
参考答案:D
本题解析:
试题分析:2SO2(g)+O2(g) 2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol
2SO3(g)? ΔH=-Q kJ·mol-1 (Q>0),该反应为放热反应,所以相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量,故A错误;该反应为可逆反应,所以将2 mol SO2(g)和1 mol
本题难度:一般
5、填空题 已知甲和乙在溶液中的转化关系如图所示: 。请回答下列问题:
。请回答下列问题:
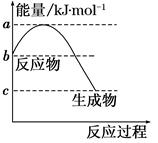
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________。该反应的热化学方程式为___________________________。
(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________0(填“>”、“<”或“=”)。
参考答案:(1)制氮肥 NH3(g)+H+(aq)===NH4+(aq
本题解析:(1)甲是10电子的阳离子,再根据转化关系知甲为NH4+,乙为HN3,NH3可用于制氮肥等;题给反应的ΔH=-(b-c)kJ·mol-1。(2)①由于第二步是液体间的反应,且氨基甲酸铵浓度较小,反应速率较慢,故合成尿素总反应的快慢由第二步决定。②Δc(CO2)=(1 mol-0.26 mol)÷0.5 L=1.48 mol·L-1,v(CO2)=1.48 mol·L-1÷10 min=0.148 mol·L-1·min-1。由第二步反应的平衡常数K随温度变化的图像可知,温度升高,化学平衡常数K增大,故温度
本题难度:一般