微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某混合粉末含有Al2O3,还可能有Fe2O3、ZnO,请设计实验探究该混合物的组成。限选择的仪器和试剂:烧杯、试管、玻璃棒、酒精灯、漏斗、过滤架、滤纸、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、10%KSCN溶液、稀氨水。
提示:ZnO、Zn(OH)2都是两性物质;且Zn(OH)2能溶于烧碱溶液生成Na2ZnO2,能溶于浓氨水生成
[Zn(NH3)4](OH)2。
(1)请写出ZnO与烧碱溶液反应的化学方程式:ZnO+2NaOH=_______________
(2)请完成以下实验探究过程
提出假设:
假设1 该混合物中除Al2O3外还含有________________;
假设2 该混合物中除Al2O3外还含有____________;
假设3 该混合物中除Al2O3外还含有Fe2O3、ZnO。
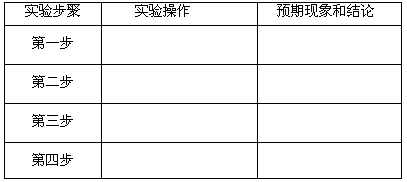
(3)设计实验方案:基于假设3,设计出实验方案。请在下表对应栏目叙述实验操作、预期现象和结论(实验步骤可以不填满、也可以增加):
参考答案:(1)Na2ZnO2 +H2O
(2)假设1:Fe2O
本题解析:
本题难度:一般
2、填空题 某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去).请回答:
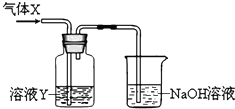
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是______反应的离子方程式为
______;NaOH溶液中发生反应的离子方程式是______
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色,取少量褪色后的溶液加热后恢复为红色,则气体X可能是______(填化学式).
参考答案:(1)氯气有强氧化性,能把亚铁离子氧化生成铁离子,离子方程式
本题解析:
本题难度:一般
3、实验题 (13分)某学校设计了一节实验活动课,让学生从废
旧干电池回收碳棒、锌皮、 、
、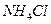 、
、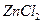 等物质,
等物质,
整个实验过程如下,请回答有关问题。
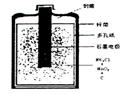
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是???????????????????????,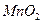
的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是?????????。
(2)??????锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3)??????氧化铵、氯化锌的提取、检验和分离。
①??????如何从黑色粉末中提取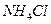 和
和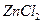 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。
????????????????????????????????????
②??????设计简单的实验证明所得晶体中含有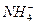 和
和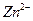 [一直
[一直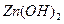 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
实验步骤
| 实验现象
| 实验结论
| 有关离子方程式
|
(a)
| ?
| ?
| ?
|
(b)
| (c)
| 说明有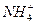
| (d)
|
(e)
| (f)
| 说明有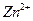
| ?
(a)??????????,(b)?????????,(c)?????????,(d)?????????,(e)????????,(f)???????,
(4)最后剩余的黑色残渣的主要成分是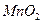 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)??????????。 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)??????????。
参考答案:(1)Zn-2e-=Zn2+;2MnO2+H2= Mn2O3
本题解析:本题考查实验学生的实验探究能力;(1)在干电池中,锌容易失电子,为电池的负极,电极反应式为:Zn-2e-=Zn2+,正极为NH4Cl得到电子,发生的电极反应为:2NH4++2e-=2NH3↑+H2↑,MnO2被氢气还原为Mn2O3,反应的化学方程式为:2MnO2+H2= Mn2O3+H2O;(3)①混合物中含有不溶物,可向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。②为证明晶体中的离子,可取少量晶体溶于蒸馏水配成溶液。取少许溶液,加入少量NaOH溶液后加热,将湿润的红石蕊试纸放在试管口,可观察到试纸变蓝?有关离子方程式:NH4++OH- NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。 NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
本题难度:简单
4、选择题 下列实验的异常情况的原因分析不正确的是
选项
| 实验内容
| 实验的异常情况
| 原因分析
| A
| 制备Fe(OH)2
| 观察不到白色沉淀
| 可能原料中的Fe2+被氧化或未隔绝空气
| B
| 蒸发结晶
| 蒸发皿破裂
| ?酒精灯灯芯碰到热的蒸发皿底部或蒸发到剩少量液体时继续加热
| C
| 分离水和CCl4
| 打开分液漏斗活塞后,下层液体难以流出
| 没有装漏斗上塞子拔掉或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
| D
| 点燃法除去CO2中的CO杂质
| 无法点燃
| CO的着火点较高
参考答案:D
本题解析:D.点燃法除去CO2中的CO杂质,无法点燃的原因在于氧气很少,二氧化碳很多,二氧化碳不支持燃烧;正确操作为,通过灼热的氧化铜粉末。
本题难度:简单
5、实验题 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
1、[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:
①切口断面处先产生气泡,反应由慢到快;
②小块合金在溶液中上下翻腾;
③溶液升温;
④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是__________________。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。

2、[实验二]向实验一的锥形瓶里滴加1mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:______________________。
3、[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加amLC1mol·L-1NaOH之后,改成滴加C2mol·L-1
HCl,所得沉淀Y(mol)与试剂总体积 V(mL)间的关系如图所示。据此,回答下列问题:

(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则C1/C2=___________;
(2)所加入NaOH溶液的体积a=______________mL。
参考答案:1、(2)合金表面有氧化膜;
(3)②测定残留固体镁的
本题解析:
本题难度:困难
|
|