微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上由废铜屑制硫酸铜晶体的流程如下:

(1)下列溶解铜屑的两种方案中,方案二的优点是???????????????。(答两点即可)
方案一:向铜屑中加入足量的浓硫酸并加热。
方案二:向铜屑中加入少量的银粉再加足量的稀硫酸并通入足量空气。
(2)测定硫酸铜晶体( CuSO4·xH2O)中结晶水数目可通过以下实验步骤确定:
Ⅰ.称取0.4820 g样品置于小烧杯中,加入适量稀硫酸,加热溶解,边搅拌边滴加BaCl2到沉淀完全;
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为0.4660 g。
回答下列问题:
①计算CuSO4·xH2O中的x=????????(要求写出计算过程)。
②步骤Ⅲ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,若其他操作均正确,则x的测定结果将??????(填“偏低”、“偏高”或“不变”)。
2、选择题 仅用一种试剂即可鉴别NaCl、FeCl3、CuCl2、Na2SO4、NH4Cl五种溶液,该试剂是( )
A.NaOH溶液
B.氨水
C.AgNO3?溶液
D.Ba(OH)2溶液
3、实验题 Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题
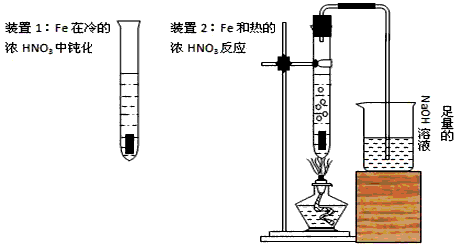
(1)甲同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:①_______________②_______________纠正上述错误后,如将装置2中的铁片改成一段一端为螺旋状的铁丝,呈螺旋状的一端深入硝酸中,另一端伸出橡皮塞外,这种改进的优点是___________________________
(2)乙同学将甲同学的Fe和浓HNO3反应后的溶液冷却,再将溶液倒入烧杯中并加入一块Cu片,发现Cu片逐渐溶解。
① 乙同学依据反应中某一现象得出了甲同学试验后HNO3过量的正确结论,他依据的反应现象是______________________________
② 乙同学认为铜片溶解可能还有另一化学反应存在的原因,该反应的离子方程式是_______________
(3)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象_______________________
(4)丙同学取0.05molCu与足量浓HNO3反应,采用了正确的试验方法,但收集产生的气体不足0.1mol,最有可能的原因是_______________(用化学方程式表示)
4、实验题 (6分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
(2)滴定结果如下表所示:
滴定
次数
| 待测溶液的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 0.20
| 20.20
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
5、实验题 铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是_________________________________。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下
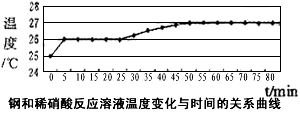
由此可得出的结论是:_____________________________。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
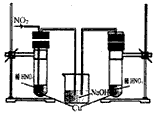
①氢氧化钠溶液的作用是_______________________。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,这样设计主要是考虑到______________________。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是_________________________________。
|