微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)准确称取一定量的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯????(B)洁净纸片??(C)直接放在托盘上
(2)准确量取10.00ml待测液于锥形瓶中,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用??????(填编号字母)作指示剂。 (A)甲基橙??(B)石蕊??(C)酚酞???
(3)若选用甲基橙作指示剂,滴定终点的判断依据是????????????????????????????
???????????????????????此时溶液显????????性。
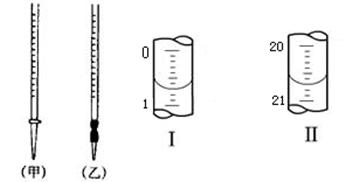
(4)0.2000mol·L-1的盐酸应装在下图所示的??????????(填甲、乙)中,图Ⅰ所示为滴定前液面,图Ⅱ所示为滴定结束时液面,根据图示计算被测烧碱溶液的物质的量浓度是??????????????mol·L-1。
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果???????????。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果?????????。
参考答案:(1)(A)??(2)(B)
(3)当加入最后一滴标准
本题解析:
试题分析:(1)氢氧化钠是易潮解的物质,所以称量时必须要用烧杯或表面皿。
(2)石蕊的变色范围为5—8,变色范围较大,不适宜做指示剂。
(3)酸滴碱用甲基橙做指示剂,甲基橙的颜色由黄变为橙色,所以滴定终点的判断依据是当加入最后一滴标准的酸液时,溶液刚好由黄色变为橙色,且半分钟无变化,甲基橙的变色范围是3.1-4.4,此时溶液呈酸性。
(4)盐酸应该用酸式滴定管盛装,因此选择甲。如图可以看出所用酸的体积为20.00mL,根据c(H+)V(H+)= c(OH-)V(OH-),可以求出
本题难度:一般
2、选择题 为中和物质的量为amol的某酸bg,需物质的量浓度为cmol/L的碱溶液的体积为
参考答案:D
本题解析:略
本题难度:一般
3、选择题 能表示人大量喝水时胃液的pH变化的图象是(??? )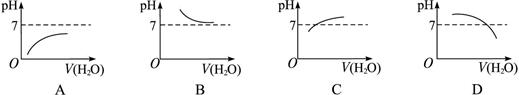
参考答案:A
本题解析:人体胃液在正常情况下显酸性pH<7,从图A、C选择,然后根据溶液稀释时不论加水再多,溶液原来性质不变即仍为酸性而选A。
本题难度:简单
4、选择题 下列热化学方程式书写正确的是(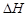 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)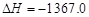 kJ/mol(燃烧热)
kJ/mol(燃烧热)
B.NaOH(aq)+HCl (aq)===NaCl (aq) +H2O(l)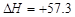 kJ/mol(中和热)
kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g)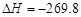 kJ/mol(反应热)
kJ/mol(反应热)
D.Fe+S===FeS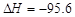 kJ/mol(反应热)
kJ/mol(反应热)
参考答案:C
本题解析:A:燃烧产物水为气态,非稳定氧化物,不正确
B:中和反应为放热反应,反应热的值应为负极,不正确
C:正确
D:各物质的状态未标明,不正确
本题难度:一般
5、选择题 下列说法正确的是
A.已知 则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O
C.已知下列热化学方程式:2H2(g)+O2(g) ="==" 2H2O(g) △H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol
D.已知中和热为-57.4kJ/mol ,则NaOH(aq) +CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H =-57.4kJ/mol
参考答案:B
本题解析:
试题分析:A、根据反应热等于反应物的键能之和减去生成物的键能之和,则CH3-CH3→CH2=CH2+H2的△H="+728.3" kJ/mol,错误;B、由反应NH3+H3O+=NH4++H2O知,氨分子能夺取水合氢离子中的氢离子,说明NH3结合H+能力比H2O强,正确;C、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,水的状态应为液态水,错误。D、中和热-57.4kJ/mol的适用条件为:稀溶液、强酸与强碱反应、生成1mol水,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)反应过程中多一个醋酸电离的吸热过程,△H >-57.4kJ/mol,错误。
考点:考查反应热的计算,燃烧热、中和热的概念。
本题难度:一般