微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质中,按能导电、是强电解质、是弱电解质、是非电解质的顺序排列的是
A.CuCaCO3冰醋酸SO2
B.CuSO4晶体NaOHNH3·H2OCH3? CH2OH
C.石墨NaClH3? PO4Cu
D.熔融NaClNa2? OAlCl3? CCl4
参考答案:A
本题解析:本题考查导电性、电解质和非电解质的判断.B项中CuSO4晶体不能导电;C项中Cu为单质,不是非电解质;D项中AlCl3在水中能完全电离,是强电解质.
本题难度:困难
2、选择题 下列溶液中粒子的物质的量浓度关系正确的是(?? )
A.0.1mol/LNaHCO3溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.25℃时,pH=2的盐酸与pH=12的氨水等体积混合后,混合液中:c(H+)=c(OH-)
C.0.1mol/LNa2S溶液中:c(HS-)+c(H2S)+c(H+)=c(OH-)
D.醋酸溶液与氢氧化钠溶液混合后溶液呈酸性,混合液中:c(CH3COO-)>c(Na+)
参考答案:D
本题解析:
本题难度:简单
3、填空题 ①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA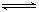 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
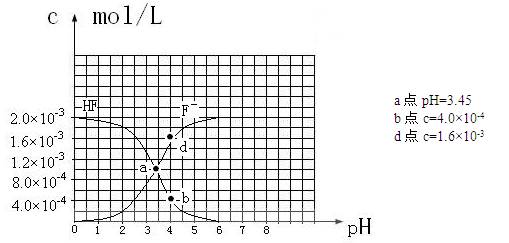
请根据以上信息回答下列问题:??????????????????????
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为??????。
(2)25℃时,HF电离常数的数值Ka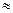 ???????????,列式并说明得出该常数的理由??????????????????????????????????????????????????????。
???????????,列式并说明得出该常数的理由??????????????????????????????????????????????????????。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为????????(填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为????,两溶液中c (F-)?????c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
参考答案:(1)Cu(OH)2(2分),?Cu2++2NH3·H2O=
本题解析:略
本题难度:一般
4、选择题 常温下,有下列4种溶液:

下列说法正确的是[???? ]
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液显酸性,则溶液中离子浓度:c(CH3COO-)>c(Na+)
参考答案:D
本题解析:
本题难度:一般
5、选择题 常温下,四种溶液的pH如下表:
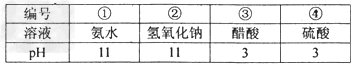
下列说法正确的是
A.?在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.?将V1?mL④溶液与V2mL②溶液混合后,测得混合溶液pH=4,则V1:V2=9:11
C.?分别加水稀释10倍,四种溶液的pH大小顺序为①〉②〉③〉④
D.?将①、④两种溶液等体积混合,所得溶液中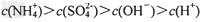
参考答案:D
本题解析:
本题难度:一般