微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列除去杂质的实验方法正确的是:?
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.用过量氨水除去Al3+溶液中的少量Fe3+
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置
参考答案:D
本题解析:A错,氧气与铜反应生成的氧化铜还会与CO气体反应生成铜与二氧化碳气体;
B错,碳酸氢钠受热不稳定分解成碳酸钠、二氧化碳和水,引入新杂质碳酸钠;
C错,铝离子、铁离子均能与过量氨水反应生成沉淀;
D正确;
本题难度:一般
2、选择题 利用下列实验装置能完成相应实验的是
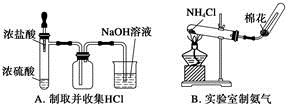
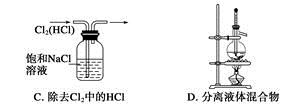
参考答案:C
本题解析:溶液倒吸导致得不到氯化氢,故A错误;氯化铵加热时分解,冷却时在导管口又生成氯化铵,所以得不到氨气,故B错误;分离沸点不同的液体混合物可以采用蒸馏的方法,温度计水银球应该在支管口处,故D错误。
本题难度:一般
3、实验题 工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
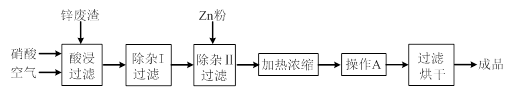
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 5.4
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.0
?
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是??????。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为?????,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ???????~??????。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加????????????溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的??????????。
参考答案:(6分)(1)适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎
本题解析:
试题分析:(1)根据外界条件对反应速率的影响可知,适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率。
(2)双氧水具有强氧化性,所以“除杂I”步骤中,需再加入适量H2O2溶液将亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4;又因为铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)由流程图及离子沉淀的pH可知,滤液中还含有铜离子,所以加入Zn粉的作用除去溶液中的Cu2+。
本题难度:一般
4、选择题 0.5 molNa3PO4中所含有的离子数目为
A.6.02×1023
B.3.01×1023
C.1.204×1024
D.1.204×1023
参考答案:C
本题解析:
本题难度:困难
5、选择题 下列操作不能达到目的是( ) | 选项 | 目的 | 操作
A.
配制100 mL 1.0 mol/L CuSO4溶液
将25 g CuSO4?5H20溶于100 mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将MnO4-完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
A.A
B.B
C.C
D.D
参考答案:A.25 g CuSO4?5H2O的物质的量为0.1mol,
本题解析:
本题难度:简单
|
|