微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列物质中所含的少量杂质,下表中除杂方法正确的是
选项
| 物?质
| 所含杂质
| 除杂质的方法
|
A
| 氧化铜
| 氯化钠
| 加水溶解、过滤、蒸发结晶
|
B
| 氧气
| 水蒸气
| 通过盛有浓硫酸的洗气瓶
|
C
| 硫酸钠溶液
| 稀硫酸
| 加入过量碳酸钠溶液,过滤
|
D
| 二氧化碳
| 一氧化碳
| 点燃
参考答案:B
本题解析:
试题分析:A项:只用溶解、过滤就行了,故错;C、D项:引入新的杂质,故错。故选B。
点评:除杂一般有两种方法,将杂质彻底除去或将杂质转化为主物质,所选物质不能与主物质发生反应,也不要在除去杂质的同时又混入了其它物质。
本题难度:简单
2、填空题 (8分)有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成。为了判断其中的成份,某同学设计了如下实验方案,并 进行了实验现象的假设,请你帮助他对这些假设作一些判断: 进行了实验现象的假设,请你帮助他对这些假设作一些判断:
实验步骤
| 实验现象
| 判??????断
| 取固体溶于水
| ①若只得到蓝色溶液
| 一定没有____________________________。
| ②若有白色沉淀,静置,上层溶液无色
| 一定没有___________________________。
| 取②的混
合物过滤
| ③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀
| 一定含有_____________________________,
沉淀中加入盐酸的离子方程式:
_______________________________________。
能否确定原固体中是否含有NaCl,并说明理由
_______________________________________
_______________________________________。
?
参考答案:
实验步骤
实验现象
判??????断
本题解析:略
本题难度:一般
3、实验题 (8分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
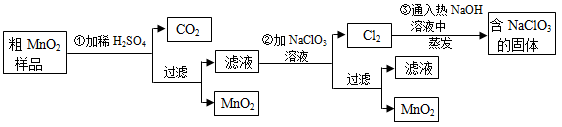
(1)第①步加稀H2SO4时,粗MnO2样品中的?????????(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是:
??????+?ClO3—+??????=?MnO2↓+?Cl2↑+??????。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、???????、???????、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0、224LCO2(标准状况下),则在第①步反应中至少需要???????mol H2SO4。
(已知摩尔质量:MnO2 -87g/mol;? MnO-71g/mol;?? MnCO3-115 g/mol)
参考答案:(8分)
(1)MnO和MnCO3(2分,对一个1分,
本题解析:(1)样品加稀硫酸后,MnO2不溶,而MnO和MnCO3均溶于其中:
MnCO3+H2SO4=MnSO4+H2O+CO2↑???? MnO+H2SO4=MnSO4+H2O
过滤后得到MnSO4滤液
(2)由图示可知,NaClO3中的氯元素化合价降为0价氯气,做氧化剂,氧化了溶液中的MnSO4,氧化产物为MnO2:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
(3)蒸发需要的仪器包括:铁架台、蒸发皿、酒精灯、玻璃棒等
(4)由上述方程式可计算出:MnCO3为0.01mol,质量为1.15g,可消耗0.01mol的硫酸,进而可计算出MnO为2.84g,也就是0.04mol,可消耗0.04mol的硫酸;故最少需要硫酸的物质的量为0.05mol
本题难度:一般
4、选择题 能鉴别Mg、AgNO3、Na2CO3、NaAlO2四种溶液的试剂是
A.HNO3
B.KOH
C.BaCl2
D.NaClO
参考答案:A
本题解析:略
本题难度:简单
5、选择题 某溶液中含有较大量的Mg2+、Ag+、Ba2+ 三种阳离子,欲将三种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液??? ②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液???? ④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①②
B.③④
C.①③
D.②④
参考答案:B
本题解析:
正确答案:B
OH― SO42―均能使两种离子沉淀,必须先加NaCl,除去Ag+后,先加OH―和SO42―均可。
本题难度:一般
|
|