N2(g)+3H2(g)?2NH3(g)
(1)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、4molH2,达到平衡后,隔板是否可能处于正中间?______(填“可能”或“不可能”),原因是______.
(2)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、2molH2,达到平衡后,隔板处于正中间,则SO2转化率与N2转化率之比为______.
(3)若起始时左侧投入2molSO2、1molO2,右侧投入1molN2、amolH2、0.1molNH3且起始时右侧体积小于左侧体积,达到平衡后,调节反应温度至某一温度(两侧温度相同),使达到平衡后,隔板处于正中间,此时SO2转化率与N2转化率之比为5:1,求a的取值范围______.
参考答案:(1)隔板处于中央,则左、右两室中混合气体的总物质的量相等,
本题解析:
本题难度:简单
2、选择题 在一定温度下,反应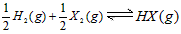 的平衡常数为9。若将1.0 mol 的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于 [???? ] 的平衡常数为9。若将1.0 mol 的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于 [???? ]
A.10%
B.18%
C.20%
D.40%
参考答案:B
本题解析:
本题难度:一般
3、选择题 合成氨反应:N2 + 3H2 2NH3?△H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡,?? t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是 2NH3?△H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡,?? t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是
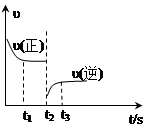
A.升高温度
B.分离出部分氨气
C.降低压强
D.增大反应物浓度
参考答案:B
本题解析:
试题分析:根据图像可知,t2时正反应速率不变,但逆反应速率突然降低,平衡向正反应方向移动,所以改变的条件应该是分离出部分氨气,即降低了生成物浓度,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对外界条件影响反应速率和平衡状态的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
4、简答题 恒温下,将16molN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(H2)=15mol,nt(NH3)=6mol,则b的值为______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时:
①原混合气体与平衡混合气体的总物质的量之比______(写出最简整数比,下同)
②达到平衡时,N2和H2的转化率之比a(N2):a(H2)______
③平衡混合气体中,n(N2):n(H2):n(NH3)______.
参考答案:(1)根据方程式计算:
N2(g)+3H2(g)?2
本题解析:
本题难度:一般
5、选择题 一定条件下的某可逆反应,其正反应速率υ(正)和逆反应速率υ(逆)随时间的变化如图所示,下列判断正确的是
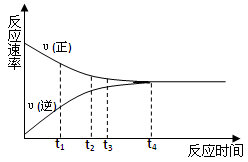
A.t1时刻,υ(正)< υ(逆)
B.t2时刻,υ(正)> υ(逆)
C.t3时刻,υ(正)= υ(逆)
D.t4时刻,υ(正)= υ(逆)
参考答案:BD
本题解析:由图像可知t4时刻之前,正反应速率总是大于逆反应速率.t4是正逆反应速率相等,反应达到化学平衡状态,所以正确的答案是BD.
本题难度:一般
|