微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:
H2(g)+?1/2O2(g)=H2O(l)??△H1=?-285.8?kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H2=?-889.6?kJ/mol
H2O(l)=H2O(g)??△H3=?+44.0?kJ/mol
(1)第③步反应的热化学方程式为______________________?。并找出CO2的等电子体___________(一到二种)
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得______?L甲烷(标准状况下)
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某研究小组向恒温(T1、T2均大于100℃)恒容容器中充入一定量的H2,在其他条件不变的情况下,改变起始CO2的物质的量测定达到平衡时CH4的体积分数,实验结果如图所示。则a、c两点处所的平衡状态中,氢气的转化率的大小关系是α(a)_______α(c)(填“>”“<”或“=”),a、b、c、d四点所处的平衡状态中,对应的平衡常数Ka、Kb、Kc、Kd的大小关系是__________________。

(4)H2和CO2在一定条件下也能转化成甲酸。甲酸,空气,质子交换膜和惰性电极组成的燃料电池工作时,负极反应物为_______发生的电极反应可表示为_____________。正极反应物为_________发生的电极反应可表示为______________。
2、选择题 甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙.则下列叙述正确的是( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的pH值逐渐升高,丙中溶液的pH逐渐减小
3、填空题 (16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
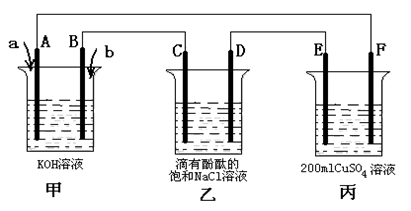
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
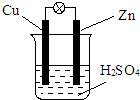
4、选择题 右图为铜锌原电池示意图,下列说法正确的是( )
A.锌极是正极
B.铜片上有气泡产生
C.电子经外电路从铜片流向锌片
D.一段时间后溶液的质量减轻
5、填空题 (6分)利用Cu + 2FeCl3 = CuCl2 + 2FeCl2反应,设计一个原电池。
(1)画出装置图(在图中标出电极材料、正负极、电解质溶液)。(2分)
(2)写出电极反应方程式
负极 :?????????????????????????????????????????????????
:?????????????????????????????????????????????????
正极:??????????????????????????????????????????????(各2分)