微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用锂制造的电池性能优越,如心脏起搏器中使用的新型Li-I2电池,其使用寿命已超过10年,Li-I2电池在使用时要不断地充电、放电,其中发生的某一化学反应可简化为:2Li+I2=2LiI,下列说法正确的是[???? ]
A.负极反应是2I--2e-=I2?????????
B.该电池以LiI水溶液为电解质溶液
C.以惰性非水有机溶剂为电解质????
D.这是电池放电的化学反应
参考答案:C
本题解析:
本题难度:一般
2、填空题 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlClx-SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑。请回答下列问题:
(1)电池的负极材料为?????????,发生的电极反应为?????????????。
(2)电池正极发生的电极反应为???????????。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是??????????????,反应的化学方程式为??????????????。
(4)组装该电池必须在无水、无氧的条件下进行,原因是???????????。
参考答案:(1)锂?? Li- e-=? Li+?
(2)2SO
本题解析:
试题分析:分析反应的化合价变化,可得Li为还原剂,发生氧化反应,SOCl2为氧化剂,发生还原反应。(1)负极材料为Li(还原剂),Li- e-=Li+。?
(2)正极反应式可由总反应减去负极反应式得到:2SOCl2+4e-=4Cl-+S+SO2↑?
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气体生成。?
(4)因为构成电池的两个主要成份Li能和氧气水反应,且SOCl2也与水反应。所以组装该电池必须在无水、无氧的条件
本题难度:一般
3、填空题 27.(14分)氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)= mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
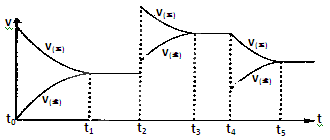
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式: 。
(5)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 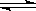 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是 .从理论上分析,该电池工作过程中 (填“需要”或“不需要”)补充碱(KOH).
参考答案:(1) bc
(2)0.01
(3)a
本题解析:
试题分析:(1)选择催化剂只能加快反应速率,但不影响平衡的移动,H2的转化率不变;增大压强,平衡向体积缩小的方向移动,即平衡正向移动,H2的转化率增大;分离出NH3,生成物浓度降低,平衡正移,H2的转化率增大;升高温度,平衡向吸热的方向移动,即逆向移动,H2的转化率降低。
(2) N2(g)+3H2(g)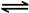 2NH3(g)
2NH3(g)
始 1.2 1.6 0
转 0.2 0.6 0.4
平 1 1 0.4
V(N2)= mol/(L·S)="0.01" mol/(L·S)
mol/(L·S)="0.01" mol/(L·S)
(3)2NO(g)+O2(g)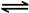 2NO2(g) △H>0,反应为气体体积减小的放热反应,a.该反应是气体物质的量减小的反应,恒温恒容时,压强不变,说明达到平衡;b.正反应是放热反应,升高温度,平衡逆向移动,在t2时,正逆速率都增大,且正反应速率增大更多,平衡正移,该反应是气体体积减小的反应,增大压强平衡正移,转化率增大,不是升温变化;c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态;d.由图可知,在t2时,改变条件平衡正移,t3时达到平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡正移,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值最大。
2NO2(g) △H>0,反应为气体体积减小的放热反应,a.该反应是气体物质的量减小的反应,恒温恒容时,压强不变,说明达到平衡;b.正反应是放热反应,升高温度,平衡逆向移动,在t2时,正逆速率都增大,且正反应速率增大更多,平衡正移,该反应是气体体积减小的反应,增大压强平衡正移,转化率增大,不是升温变化;c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态;d.由图可知,在t2时,改变条件平衡正移,t3时达到平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡正移,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值最大。
(4)制备肼的方法,是以次氯酸钠氧化氨气,反应中还原剂与氧化剂的物质的量之比为2:1,制得肼的稀溶液,反应为NaClO+2NH3=N2H4+NaCl+H2O
(5)根据盖斯定律,△H=①×2-②×2+③×3=905.2kJ/mol,那么17g即1mol氨气催化氧化所放出的热量为 ×905.2kJ/mol="226.25" kJ
×905.2kJ/mol="226.25" kJ
(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨气作为燃料电池燃气时,负极上史氨气失电子的过程,即2NH3+6OH——6e—=N2+6H2O;正极反应为O2+2H2O+4e-=4OH-,根据电子守恒分析,正负极反应和生成的OH-相同,理论上分析不需要补充KOH。
考点:化学平衡及影响因素、热化学方程式、化学电源、
点评:本题考查了盖斯定律、影响平衡速率的因素、平衡的判断、燃料电池的相关知识,难度中等,注意图像变化的分析。
本题难度:困难
4、选择题 下图所示的装置中,有关说法不正确的是
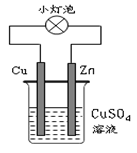
A.该装置实现化学能转变为电能
B.该装置中Cu2+向Zn电极移动
C.该装置外电路中电子由Zn棒转移到Cu棒
D.该装置中Zn棒上的电极反应为:Zn-2e-=Zn2+
参考答案:B
本题解析:
试题分析:该装置为原电池装置。原电池是将化学能转变为电能的装置,在原电池中。较活泼的金属做负极,不活泼的金属或非金属做正极。负极失去电子发生氧化反应,失去的电子转移到正极,使正极附近集聚很多的电子,电子带负电,故能吸引电解质溶液中的阳离子,阳离子在正极附近得到电子,发生还原反应。所以在这个原电池的装置图中,我们知道锌做负极,铜做正极。电子的流动方向是负极流向正极即电子应由锌极流向铜极。电解质溶液中的铜离子应是向铜极移动。所以B选项是错误的
考点:考查原电池的相关知识
本题难度:一般
5、选择题 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是

A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
参考答案:D
本题解析:
试题分析:A、读图可知,氧元素由—1价降为—2价,发生还原反应,则b为电池的正极,氢由—1价升为+1价,发生氧化反应,则a为电池负极,阳离子从负极区移向正极区,故Na+从a极区移向b极区,错误;B、根据电子、电荷、原子守恒可知,正极反应式为H2O2+2e—=2OH—,故每消耗1.5molH2O2,转移3mol电子,错误;C、若MnO2作催化剂,双氧水应该分解为氧气和水,故MnO2无催化作用,错误;D、根据电子、电荷、原子守恒可知,负极反应式为BH4-+8OH--8e-=BO2-+6H2O,正确。
考点:考查新型化学电源、原电池原理等相关知识。
本题难度:一般