解释
A
Cl2可使含有酚酞的氢氧化钠溶液褪色
干燥的氯气具有漂白性
B
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
说明该溶液中含有SO42-
C
SO2可使酸性KMnO4溶液褪色
SO2具有漂白性
D
浓硝酸在光照下颜色变黄
浓硝酸不稳定
A.A
B.B
C.C
D.D
参考答案:A.干燥的氯气不具有漂白性,氯气与水反应生成具有漂白性的HC
本题解析:
本题难度:一般
2、实验题
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
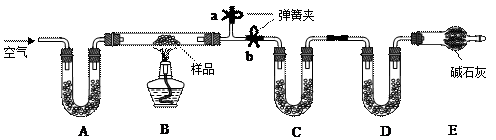
⑴加热前通入空气的目的是____????????????????? ___,操作方法为______________________________________________。
⑵装置A、C、D中盛放的试剂分别为A_______,C______,D______。
⑶若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3·10H2O的含量__________。
⑷若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中
NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)
参考答案:⑴赶走装置中空气含有的水蒸气和二氧化碳,关闭b,打开a,缓缓
本题解析:该题综合考查元素化合物性质,测定混合物中各成分的质量分数。解题时必须结合实验装置和物质的性质进行综合分析。将混合物加热,产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,即C中的干燥剂吸水后不能吸收CO2。由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量。由C的增重(Na2CO3·10H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO3·10H2O的质量,从而求出NaCl的质量。故应在实验前想法赶出装置中的空气,关键操作应是赶B中的空气,所以关闭b,打开a就成为操作的关键,缓缓通入则是为了赶出效果更好。E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果。
本题难度:一般
3、实验题 某学生设计氨催化氧化实验(在催化剂存在时氨被氧气氧化生成NO和H2O),并将制得的NO进一步氧化为NO2,再用水吸收NO2并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图 ? 另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。
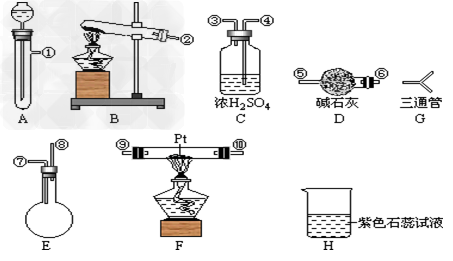
设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应为_______________,该反应应在装置____中进行。
(2)为快速制NH3和O2,制取NH3的装置最好选择_______,其化学反应方程式为______________;制取O2的装置最好选择_______,其化学反应方程式为________________。
(3)各仪器按气流方向连接的正确顺序为A、B→G→?______→?______→C?→?E→_____?[按装置先后顺序排列]
(4)如果实验前需收集一试管的氨气,如何采用一种简易方法检验试管中氨气是否集满(简述操作、现象和结论)______________???????
(5)装置C的作用是___________________。
(6)若经充分反应,从H中排出的气体对大气不会造成污染。装置E的使用方法是将E倒置,⑦为进气口,⑧为出气口,⑧插入H装置中.H中溶液变红,其原因是(用化学方程式表示)______________________。
参考答案:(1)4NH3+5O2?=4NO+6H2O;F
(2)
本题解析:
本题难度:一般
4、实验题 为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
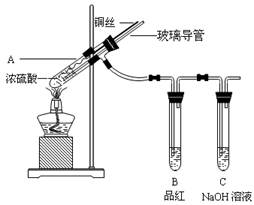
(1)、装置A中发生反应的化学方程式为:???????????????????????????
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是:??????????????????????。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:????????????????????????????。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
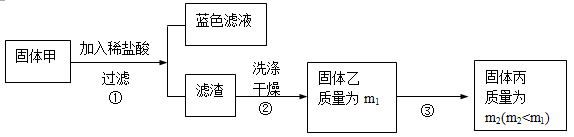
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是:???????????????????????????????????。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
???????????????????????????????????????????。
(5)、确定乙是否煅烧完全的操作是:?????????????????????????????????????????????。
(6)、煅烧过程中一定发生的化学反应方程式为:???????????????????????????????????。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq)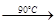 ?NH4ClO4(aq)+NaCl(aq) ?NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:????????
?????????????????????????????????????????????。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩,??????????,过滤,???????????、干燥。
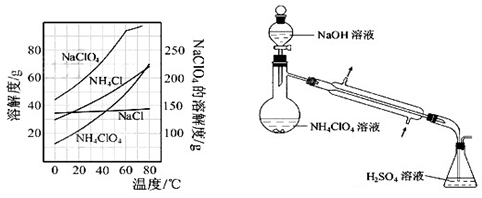
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:

(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是????????????????。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是?????????????(填写步骤编号)。
(11)、必须重复实验2~3次,其原因是???????????????????????????????????????????。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g。该实验
的相对误差为?????????????。
参考答案:
Cu+2H2SO4(浓) 本题解析:(1) Cu+2H2SO4(浓) 本题解析:(1) Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O
(2) 试管A中气体压强减小,空气可以通过导管进入试管A中保持A中压强不变;
从导管口向A中大量鼓气
(3) 取最后一次洗涤液于试管中,滴加硝酸银溶液,若无白色沉淀产生,说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净。
(4)泥三角、坩埚、坩埚钳
(5) 再煅烧、冷却、称量,直至恒重,前后两次称量差不超过0.1g。
(6) 2CuS+3O2 2CuO+2SO2 2CuO+2SO2
(7) 氨气与浓盐酸反应放出热量
(8) 从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩,????????冷却结晶、过滤,洗涤、干燥。
(9) 酸式滴定管
(10)实验中确保生成的氨被稀硫酸完全吸收的实验步骤是1、5、6
(11) 必须重复实验2~3次,其原因是减少实验误差
(12) 该实验的相对误差为【(0.095g—0.093)/0.095g】×100%≈3.16%
本题难度:简单
5、实验题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态))
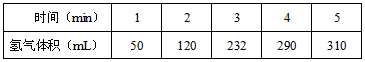
(1)哪一时间段___________(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是_____________。
(2)哪一段时段的反应速率最小__________________,原因是_________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)______________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)________________。
参考答案:(1)2~3min;因为该反应是放热反应,2~3min时温度
本题解析:
本题难度:一般
|