微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料.实验室用硫铁矿烧渣(Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如图所示.请回答有关问题:
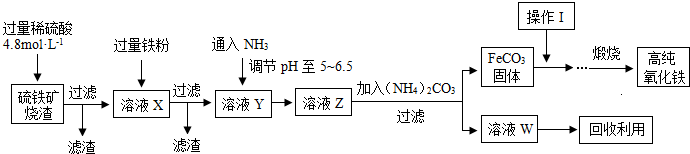
(1)过滤操作中的玻璃仪器为______.
(2)实验室需240mL4.8mol?L-1的硫酸溶液,若用18.4mol?L-1的浓硫酸进行配制,所需要的最主要仪器为______.
(3)溶液X发生反应的离子方程式为______.
(4)简述如何检验溶液Z中的阴离子______.
(5)操作I的名称是______.列举W的一种用途______.
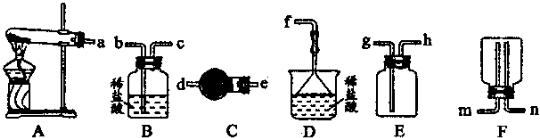
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理.选择合适的仪器,按照气体流向排序(如图所示大写字母表示)______.
(7)将多余的氨气通入水中,若得到25℃0.2mol?L-1的NH3?H2O溶液,现提供0.1 mol?L-1盐酸溶液,请你设计实验,证明NH3?H2O的电离程度大于NH4Cl的水解程度.简述实验方案及结论______.
参考答案:(1)过滤时要注意一贴、二低、三靠.一贴是指滤纸紧贴漏斗内壁
本题解析:
本题难度:一般
2、选择题 下列化学实验事实及其解释都正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应
B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑
该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
参考答案:B
本题解析:略
本题难度:一般
3、填空题 (15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。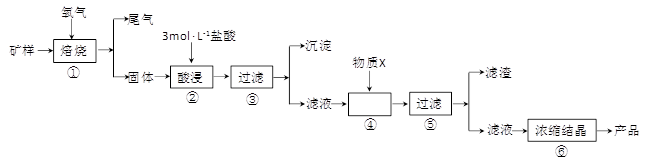
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
金属离子
| 氢氧化物开始沉淀的pH
| 氢氧化物沉淀完全的pH
|
Fe2+
| 7.0
| 9.0
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
回答下列问题:
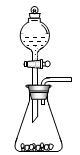
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠?????????(B)稀盐酸?????????(C)氨水?????????(D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
参考答案:(1)2H2O2 ="==" 2H2O + O2 ↑,2Na
本题解析:
试题分析:(1)根据装置图可知是固液不加热制气体,所以用H2O2和Na2O2来制取O2反应方程式为:2H2O2 ="==" 2H2O + O2 ↑,2Na2O2 + 2H2O ="==" 4NaOH + O2 ↑。(2)尾气中含有的是SO2,SO2没有强氧化性不能与NH3反生氧化还原反应,SO2有较强的还原性,可以被空气中的O2所氧化,所以可能发生的氧化还原反应为2H2SO3+O2=2H2SO4,2(NH4)2SO3+O2=2(NH4)2SO4,2NH4HSO3+O2=2NH4HSO4(3)配制3mol · L-1的盐酸100 mL除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100 mL容量瓶、量筒。(4)根据氢氧化物开始沉淀和完全沉淀的pH可知,只要调节pH值,就可以Fe3+以Fe(OH)3沉淀的形式析出,达到除杂的目的。为了不引入新杂质,还能调节pH值,所以选铜的难溶物,如CuO、Cu(OH)2、CuCO3等。(5)Fe(OH)2完全沉淀的pH是9.0,所以Ksp[Fe(OH)2]=c(Fe2+)·c2(OH-)=1×10-5×(1×10-5)2=1×10-15。
点评:本题属于实验与理论的结合,难度适中,高考中的热门题。
本题难度:一般
4、选择题 在实验室进行物质制备,下列设计中,理论上正确、操作上可行、经济上合理、环境上友好的是( )
A.C 点燃
COCuO
△
CO2NaOH溶液
Na2CO3
B.Cu
AgNO3溶液
Cu(NO3)2溶液NaOH溶液
Cu(OH)2
C.Fe点燃
Fe2O3硫酸溶液
Fe2(SO4)3溶液
D.CaO
H2O
Ca(OH)2溶液Na2CO3
溶液
参考答案:A、碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生
本题解析:
本题难度:简单
5、选择题 下列实验操作正确且能达到预期目的的是(??)
?
| 实验目的
| 操作
| ①
| 比较水和乙醇中羟基氢的活泼性强弱
| 用金属钠分别与水和乙醇反应
| ②
| 欲证明CH2=CHCHO中含有碳碳双键
| 滴入KMnO4酸性溶液,看紫红色是否褪去
| ③
| 欲除去苯中混有的苯酚
| 向混合液中加入浓溴水,充分反应后,过滤
| ④
| 证明SO2具有漂白性
| 将SO2通入酸性KMnO4溶液中
| ⑤
| 比较确定铜和镁的金属活动性强弱
| 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液
| ⑥
| 确定碳和硅两元素非金属性强弱
| 测同温同浓度Na2CO3和Na2SiO3水溶液的pH
?
A.①④⑤?????B.②③⑤????? C.①⑤⑥?????D.①②③④⑤⑥
参考答案:C
本题解析:②中—CHO干扰碳碳双键的检验,错误;③除去苯中的苯酚应用NaOH溶液,错误;④SO2能使酸性KMnO4溶液褪色,是因为其还原性,错误。
本题难度:一般
|
网站客服QQ: 960335752 - 14613519 - 791315772
|