微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将标准状态下的vL某气体(相对分子质量为M)溶于水中,所得溶液的溶质质量分数为b%.将溶液蒸发掉a?g水后(该气体溶质不挥发),所得溶液的溶质质量分数为2b%,密度为ρg/mL,物质的量浓度为c?mol/L.下列关系式不正确的是
A.c=
B.c=
C.b%=
D.b%=
参考答案:D
本题解析:分析:根据n= 计算气体的物质的量,根据c=
计算气体的物质的量,根据c=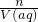 =
=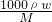 来计算,并结合质质量分数为b%变为溶液的溶质质量分数为2b%,则蒸发水的质量为溶液质量的一半,以此来计算.
来计算,并结合质质量分数为b%变为溶液的溶质质量分数为2b%,则蒸发水的质量为溶液质量的一半,以此来计算.
解答:A.气体的物质的量为 mol,蒸发后溶液的质量为ag,则c=
mol,蒸发后溶液的质量为ag,则c= =
= ,故A正确;
,故A正确;
B.根据c=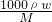 可知,稀释后c=
可知,稀释后c=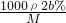 =
= ,故B正确;
,故B正确;
C.根据b%= 可知,b%=
可知,b%=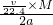 ×100%=
×100%=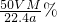 ,故C正确;
,故C正确;
D..根据c=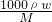 可知,b%=
可知,b%=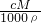 ,故D错误;
,故D错误;
故选D.
点评:本题考查物质的量浓度的有关计算,明确物质的量浓度的计算公式及物质的量浓度与质量分数的换算公式即可解答,题目难度不大.
本题难度:一般
2、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L二氯甲烷的分子数约为NA个
B.1molNa2O2固体中含离子总数为3NA
C.1mol/LCuCl2溶液中含有Cl-的个数为2NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
参考答案:B
本题解析:分析:A、标准状况下,二氯甲烷是油状液体,不是气体;
B、1molNa2O2固体中含2mol钠离子和1mol过氧根离子;
C、氯离子的数目和氯离子的浓度以及溶液的体积有关;
D、粗铜中含有比金属铜活泼的金属铁、锌等,电解时,阳极放电的先是铁和锌,最后是铜.
解答:A、标准状况下,二氯甲烷不是气体,所以22.4L二氯甲烷的物质的量不是1mol,故A错误;
B、1molNa2O2固体中含2mol钠离子和1mol过氧根离子,即离子的总数为3NA,故B正确;
C、不知道溶液的体积,据n=cV,则不能确定氯离子的物质的量,所以无法确定其数目,故C错误;
D、粗铜中含有比金属铜活泼的金属铁、锌等,电解时,阳极放电的先是铁和锌,最后是铜,所以当转移的电子数为2NA个时,则阳极溶解的铜的质量小于64g,故D错误.
故选B.
点评:本题是一道有关物质的量和阿伏伽德罗常数的计算题,要求学生熟悉教材基本知识,学以致用.
本题难度:简单
3、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0?L?0.1?mol?L-1?Na2CO3溶液中所含的CO离子数为0.1NA
B.质量均为7.8?g?Na2S、Na2O2的固体中含有的阴离子数均为0.1NA
C.标准状况下,22.4?L的CCl4分子中含有共价键数为4NA
D.电解饱和食盐水,当阴极产生2.24?L?H2时,转移的电子数一定为0.2NA
参考答案:B
本题解析:分析:A、碳酸钠溶液中碳酸根离子水解;
B、依据n= 计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
C、CCl4分子在标准状况下不是气体;
D、不是标准状况,气体体积2.24 L H2不一定是0.1mol;
解答:A、碳酸根离子水解,1.0 L 0.1 mol?L-1 Na2CO3溶液中所含的CO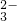 离子数小于0.1NA,故A错误;
离子数小于0.1NA,故A错误;
B、7.8 g Na2S、Na2O2的固体物质的量都是0.1mol,过氧化钠是钠离子和过氧根离子构成,所以含有的阴离子都为0.1mol,阴离子数均为0.1NA,故B正确;
C、CCl4分子在标准状况下不是气体,22.4 L的CCl4分子不是1mol,故C错误;
D、阴极产生2.24 L H2时,温度和压强不一定是标准状况,所以物质的量不一定是0.1mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,题目难度中等.
本题难度:一般
4、选择题 200mlFe2(SO4)3溶液中含Fe3+56g,溶液中SO42-的物质的量浓度是
A.5mol/L
B.7.5?mol/L
C.10?mol/L
D.2.5?mol/L
参考答案:B
本题解析:分析:根据化学式Fe2(SO4)3可知,溶液中n(SO42-)= n(Fe3+),根据n=
n(Fe3+),根据n= 计算56gFe3+的物质的量,再根据c=
计算56gFe3+的物质的量,再根据c= 计算溶液中SO42-的物质的量浓度.
计算溶液中SO42-的物质的量浓度.
解答:56gFe3+的物质的量为 =1mol,溶液中n(SO42-)=
=1mol,溶液中n(SO42-)= n(Fe3+)=
n(Fe3+)= ×1mol=1.5mol,所以溶液中SO42-的物质的量浓度
×1mol=1.5mol,所以溶液中SO42-的物质的量浓度 =7.5mol/L.
=7.5mol/L.
故选B.
点评:本题考查物质的量浓度的计算,难度不大,根据化学式判断铁离子与硫酸根的关系是解题关键.
本题难度:困难
5、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1mol水含有NA个H+和NA个OH-离子
B.在通常状况下,22.4?LH2和4?gHe均含有NA个分子
C.8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
参考答案:C
本题解析:分析:A、水是弱电解质存在电离平衡;
B、22.4?LH2在通常状况下不是1nol;
C、质量换算物质的量分别计算物质含有的铜原子比较;
D、等物质的量铁和氯气反应生成三氯化铁,结合化学方程式的过量计算判断;
解答:A、水是弱电解质不能完全电离,故A错误;
B、在通常状况下,22.4?LH2物质的量不是1mol,故B错误;
C、8.0?g?若全是Cu2S含铜原子= =0.1mol;8.0?g?若全是CuO含铜原子=
=0.1mol;8.0?g?若全是CuO含铜原子=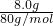 =0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
=0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
D、0.1mol铁与0.1molCl2充分反应铁有剩余,转移电子数用全反应的氯气计算为0.2mmol,故D错误;
故选C.
点评:本题考查了弱电解质的电离平衡,气体摩尔体积的条件应用,质量换算物质的量计算微粒数,氧化还原反应的过量计算电子数的计算.
本题难度:一般