微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2===2CO2+4H2O。下列有关该电池的说法错误的是( )

A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:2CH3OH+2H2O-12e-===2CO2↑+12H+
D.电池正极的反应式为:3O2+12H++12e-===6H2O
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据电子的流向可知左侧是负极,通入甲醇。右侧是正极,通入氧气。应用存在质子交换膜,所以选项B、C、D都是正确的,选项A不正确,答案选A。
本题难度:一般
2、填空题 (14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
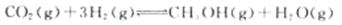
下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。

①该反应是????????????(填“吸热”或“放热”)反应。
②反应体系中加入催化剂对反应热是否有影响?????(填“是”或“否”),原因是???????????????????????????。
(2)若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图所示(实线)。
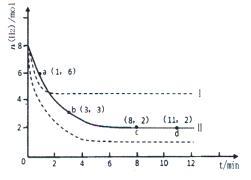
①该条件下反应的平衡常数K=????。请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是??????,曲线Ⅱ对应的实验条件改变是????。
③下列措施中能使H2转化率增大的是?????。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入3mol CO2和4mol H2
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。已知:

写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式????。
参考答案:(1)①放热(1分)?②否(1分)催化剂不能改变化学反应始态
本题解析:(1)根据图像可知,反应物的总能量高于生成物的能量,所以是放热反应。催化剂能改变活化能,但不能改变反应热。
(2)①平衡时氢气的物质的量是2mol,消耗氢气是6mo。所以根据反应式可知,消耗CO2是2mol,生成甲醇和水的物质的量都是2mol。所以平衡常数为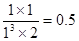 。
。
②曲线1到达平衡的时间少,说明反应速率
本题难度:一般
3、填空题 (10分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
金属
| 电子流动方向
| 电压/V
|
Fe
| Fe? → Cu
| +0.78
|
Zn
| Zn? → Cu
| +1.10
|
A
| Cu? → A
| -0.15
|
B
| B? → Cu
| +0.3
?
根据以上实验记录,完成以下填空:
(1)构成两电极的金属活动性相差越大,电压表的读数越___________(填“大”、“小”)。
Zn、A、B三种金属活动性由强到弱的顺序是__________________________。
(2)Cu与A组成的原电池,_____为负极,此电极反应式为___________________。
(3)A、B形成合金,露置在潮湿空气中,_______先被腐蚀。
参考答案:(10分)(1)大???????(2分)
(2)Zn&
本题解析:略
本题难度:简单
4、选择题 关于下列四个图像的说法中正确的是
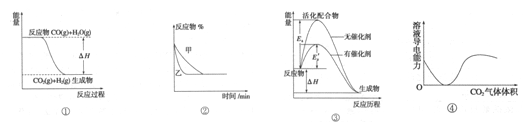
A.图①表示可逆反应CO(g)+H20(g)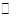 5C02 (g)+H2 (g)△H>0 5C02 (g)+H2 (g)△H>0
B.图②表示压强对可逆反应2A(g)+2B(g) 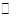 3C(g)+D(s)影响,乙的压强大 3C(g)+D(s)影响,乙的压强大
C.图③表示有无催化剂化学反应中能量变化
D.图④表示C02通人饱和碳酸钠溶液中,溶液导电性变化
参考答案:C
本题解析:A 错误表示的反应是放热反应,△H<0
B 错误2A(g)+2B(g)  ?3C(g)+D(s)改变压强,平衡会移动,图像中甲、乙平衡之后的反应物的百分含量不会相等。 ?3C(g)+D(s)改变压强,平衡会移动,图像中甲、乙平衡之后的反应物的百分含量不会相等。
C 正确使用催化剂,会降低反应的活化能
D 错误溶液中始终都存在钠离子,导电能力不可能为零。
本题难度:简单
5、选择题 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、??? B、D、E金属性由强到弱的顺序为(???)
A、D﹥A﹥B﹥E????????????????????? B、D﹥E﹥A﹥B
C、A﹥B﹥D﹥E????????????????????? D、A﹥B﹥E﹥D
参考答案:A
本题解析:
试题分析:当A、B组成原电池时,电子流动方向A→B,则金属活泼性为A>B;当A、D组成原电池时,A为正极,则金属活泼性为D>A;B与E构成原电池时,电极反应式为:E2-+2e-→E,B-2e-→B2+,B失去电子,则金属活泼性为B>E,综上所述,金属活泼性为D>A>B>E。
本题难度:一般
|