微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 高纯氧化铝可用于制高压钠灯的陶瓷管,实验室制取高纯氧化铝的流程如下:
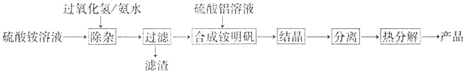
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+.检验Fe2+是否除尽的实验操作是______.
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是______.
(3)上述流程图里,“结晶”这步操作中,母液经______?????得到铵明矾(含结晶水).
(4)上述流程图里,“分离”这个步骤应包含的是______???(填字母代号)
A.蒸馏B.分液C.过滤D.洗涤晶体.
参考答案:(1)检验Fe2+是否除尽的实验操作是:取少量除杂后的滤液,
本题解析:
本题难度:一般
2、实验题 (5分)现有A、B两种金属分别与盐酸反应,产生氢气的速率相近。请设计一个原电池实验证明A、B两种金属的活动性。
参考答案:将A、B两种金属片用导线连接放入盐酸中组成原电池,有气泡逸出
本题解析:当活动性不同的金属组成原电池时,相对活泼金属失电子,在相对不活泼金属上氢离子得电子,析出氢气。
本题难度:简单
3、实验题 (16分)实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
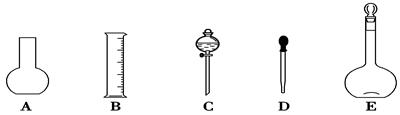
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列是通过使用质量分数为98%(密度为1.84 g·cm-3)的浓硫酸来配制500 mL 0.5 mol·L-1硫酸溶液的操作步骤,其正确的操作顺序是?????????????????????????(填序号)。
A.把容量瓶活塞塞上,反复摇匀后,装贴标签以保存
B.加入蒸馏水进容量瓶中进行定容,待水面离刻度线只有1~2厘米时,采用胶头滴管滴加蒸馏水使其凹液面正好与刻度线相切
C.在烧杯中注入适量的蒸馏水,用量筒准确量取98%的浓硫酸13.3ml慢慢注入烧杯中,并不停地搅拌使之稀释均匀
D.通过计算需要量取98%(密度为1.84 g·cm-3)的浓硫酸13.3ml
E.待烧杯中稀释的硫酸溶液冷却至室温后,通过玻璃棒引流转移至500ml的容量瓶中
F.把玻璃棒和烧杯分别都洗涤2~3 次,洗涤液也转移至容量瓶
次,洗涤液也转移至容量瓶
(3)根据计算用 托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1?(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N
托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1?(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
(4)在容量瓶的使用方法中,下列操作不正确的是???????(填写标号).
A.使用容量瓶前检查它是否漏水.
B.容量瓶用蒸馏水洗净后,不需要进行烘干就可以直接使用.
C.配制溶液时,如果 试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线.
参考答案: 本题解析:略
本题解析:略
本题难度:一般
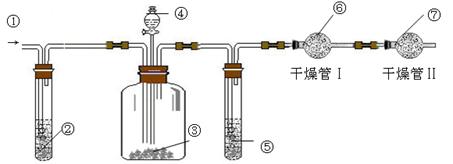
4、实验题 .利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A)?????????(B)??????????(C)???
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
①?????、②?????、③?????、④?????、⑤?????、⑥??????、⑦??????.
(2)实验中使用了空气,其作用是??????????????????????;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量???????(填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是???????????????????????????????,若缺乏干燥管Ⅱ,其后果是??????????????????????.
(4)若分液漏斗中④的滴液速度过快,将导致实验结果?????(填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为?????????。
参考答案:(1)① g?② f?③? d?④b ?⑤? a ?⑥? e
本题解析:(1)根据装置图可知,实验原理是利用碳酸钠和酸生成CO2,如果吸收CO2来计算碳酸钠的质量,由于生成的CO2中含有水蒸气,所以在通入碱石灰之前,还需要首先除去水蒸气。又因为装置中会残留CO2,所以还必需通入空气排尽装置的CO2。但其中也含有CO2,所以通入的可知首先要除去CO2,且还必需防止空气中的水蒸气和CO2被碱石灰吸收,所以正确顺序是① g?② f?③? d?④b ?⑤? a ?⑥? e ?⑦? e 。
(2)根据以上分析可知,使用空气的目的是使反应产生的CO2气体充分排出;;若通入空气的速度过快或通入空气的量不足,则生成的CO2不能完全气被吸收,因此结果偏低。
(3)由于空气中也含有水蒸气和CO2,所以干燥管Ⅱ的作用是防止空气中的CO2和H2O被吸入干燥管Ⅰ中;如果没有该装置,则吸收的CO2增加,碳酸钠的质量分数会偏大。
(4)若分液漏斗中④的滴液速度过快,则碳酸钠反应不完全,生成的CO2减少,测定结果偏低。
(5)干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则生成的CO2质量是(m2-m1)g,所以碳酸钠的质量就是(m2-m1)÷44×106,因此质量分数是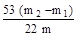 ×100%.。
×100%.。
本题难度:一般
5、简答题 为了探究HClO的漂白性,某同学设计了如图的实验.
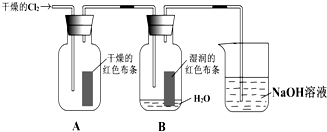
(1)实验室用二氧化锰与浓盐酸共热制得氯气,请写出发生反应的化学方程式______.
(2)通入Cl2后,从集气瓶A中干燥的红色布条不褪色的现象,可得出的结论是______;从集气瓶B中湿润的红色布条褪色的现象可得出的结论是______.
(3)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.
参考答案:(1)实验室用二氧化锰与浓盐酸共热生成氯气、氯化锰和水,反应
本题解析:
本题难度:一般