微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
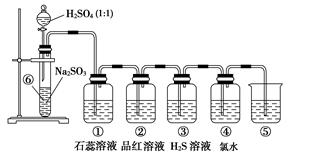
(1)⑥中发生的化学反应方程式为______________________________________(2分)
(2)⑤的作用是_______________________________________________________(2分),
反应的离子方程式为___________________________________________________(2分)
(3)填表格(每空1分)
装置
| 实验现象
| 体现SO2的性质
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
|
④
| ?
| ?
参考答案:(1)Na2SO3+H2SO4===Na2SO4+H2O+S
本题解析:
试题分析:(1)硫酸和亚硫酸钠反应生成SO2,则⑥中发生的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)SO2是大气污染物,因此氢氧化钠溶液的作用是吸收过量的SO2,防止污染环境,反应的离子方程式为SO2+2OH-=SO+H2O。
(3)SO2是酸性氧化物,溶于水显酸性,石蕊试液变红色;SO2具有漂泊性,能使品红溶液褪色;SO2具有氧化性,能把H2S氧化生成单质S沉淀;另外SO2还具有还原性,能被氯水氧化,使氯水褪色。2的制备、SO2性质的检验以及尾气处理
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、选择题 下图是一种试验某气体化学性质的实验装置。在A处通入氯气,图中B为开关,关闭B时,C中干燥的红色布条颜色无变化;打开B时,C处干燥的红色布条颜色褪去。由此做出的判断正确的是

[???? ]
A.D中可以是水
B.D中可以是饱和食盐水
C.D中不可能是浓H2SO4
D.通入的氯气中含有水
参考答案:D
本题解析:
本题难度:一般
3、实验题 他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:

(1)该同学的实验目的是____________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙 同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是___________;应该测定的实验数据是_____________。

参考答案:(1)反应物本身的性质对反应速率的关系;温度相同
(
本题解析:
本题难度:一般
4、实验题 铁碳合金是以铁和碳为组元的二元合金,某化学学习小组设计了如图装置进行探究:
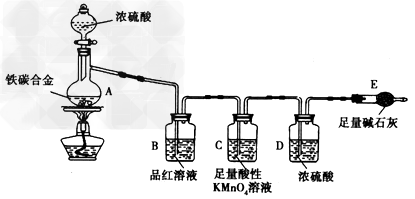
Ⅰ.浓硫酸的某些性质的定性探究:
(1)A中铁与浓硫酸发生反应的化学方程式是____________________。
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,观察A、B中的现象为________________________。
Ⅱ.铁碳合金中铁的定量探究:
(3)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后____________,则证明装置的气密性良好。
(4)装置C的作用是______________________________________________________。
(5)称量E的质量,并蒋ag铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为_________________________________。
(6)甲同学认为,依据此实验测得的数据计算合金中铁的质量分数可能会偏低,原因是空气中的CO2、H2O进入E 中使b增大。改进的方法是______________________________________________。
(7)乙同学认为,甲同学改进实验方法后,依据此实验测得的合金中铁的质量分数可能会偏高。你认为其中的原因是____________________________________________________________________________。
参考答案:(1)2Fe+6H2SO4(浓)![]() 本题解析: 本题解析:
本题难度:一般
5、实验题 将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
猜想
| 实验操作
| 预期现象
| 猜想一:Fe元素只显______价
| ①向所得溶液中滴入KSCN溶液
②向稀酸性KMnO4溶液中滴入所得溶液
| KSCN溶液无明显现象
| 猜想二;Fe元素只显______价
| 稀酸性KMnO4溶液颜色_____
| 猜想三:Fe元素既有+2价又有+3价
| KSCN溶液呈______色
稀酸性KMnO4溶液颜色______
?
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是????????
???????????。
②装置图中C的作用是?????????????????。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是?????????????????????????????????????
参考答案:
猜想一:+2
猜想二: +3?褪为无色
本题解析:略
本题难度:简单
|
|