微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
①用物质A表示的反应平均速率为0.3mol∕(L·s)②用物质B表示的反应的平均速率为0. 6 mol∕(L·s)③2s时物质A的转化率为70%?④2s时物质B的浓度为0. 7mol-L-l其中正确的是
A.③④
B.②③
C.①④
D.①③
参考答案:C
本题解析:
试题分析:V(C)=ΔC∕Δt=(0.6mol∕L)∕2s=0.3mol∕(L·s).根据同一化学反应各物质的速率关系:V(A) :V(B) :V(C)=2:1:2可得V(A)=" V(C)=" 0.3mol∕(L·s).①正确。V(B) =(1∕2)×V(C)= (1∕2)×0.3mol∕(L·s)="0.15" mol∕(L·s) ②错误。③2s时物质A的转化率是:{0.3mol∕(L·s) ×2s }∕(4mol÷2L) ×100%=30%.错误。④2s时物质B的浓度为(2mol÷2L)-
本题难度:一般
2、选择题 下列措施中肯定能使化学反应速率增大的是[???? ]
A.增加反应物的量????
B.增大反应体系的压强 ????
C.降低反应体系的温度????
D.使用适宜的催化剂
参考答案:D
本题解析:
本题难度:简单
3、选择题 在1L密闭容器发生反应:4NH3(g)+5O2(g) 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
时间/浓度
| c(NH3)( mol·L-1)
| c(O2)( mol·L-1)
| c(NO)( mol·L-1)
|
起始
| 0.8
| 1.6
| 0
|
第2min
| 0.6
| a
| 0.2
|
第4min
| 0.3
| 0.975
| 0.5
|
第6min
| 0.3
| 0.975
| 0.5
|
第8min
| 0.7
| 1.475
| 0.1
|
第10min
| 0.7
| 1.475
| 0.1
下列说法错误的是
A.反应在第2min到第4min时,O2的平均速率为0.1875 mol·L-1·min-1
B.反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4min、第8min时分别达到化学平衡,且平衡常数相同
D.在开始反应的前2min内,该反应放出0.05QKJ的热量
参考答案:C
本题解析:
试题分析:A. 反应在第2min到第4min时V(NH3)=(0.6-0.3)mol/L÷2min=0.15mol/(L·min);V(O2)=" 5/4" V(NH3)= 5/4×0.15mol/(L·min)=0.1875mol/(L·min).正确。B.反应从开始到2min时Δc(NH3)=0.2mol/L,所以根据方程式中与氧气的关系,氧气的浓度改变数值为5/4×0.2mol/L=0.25mol/L。因此a=1.35mol/L.在第2min时改变了某一条件,使反应速率大大加快。改变的条件可
本题难度:一般
4、选择题 下列图示与对应的叙述相符的是( )
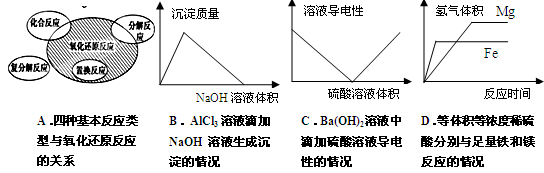
参考答案:A
本题解析:
试题分析:A、根据置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,化合反应与分解反应不一定是氧化还原反应判断,正确;B、AlCl3溶液中加氢氧化钠溶液发生的反应为
Al3+ + 3OH-=Al(OH)3↓,Al(OH)3 + OH-=AlO2- + 2H2O,生成Al(OH)3沉淀和沉淀溶解所需氢氧化钠溶液的体积比为3:1,与图像不符,错误;C、Ba(OH)2溶液中滴加硫酸溶液发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,溶液中的Ba2+和OH-浓度在减少,导电性会减弱但不会丧失导电性,随着滴加H2SO4逐渐过量,溶液中自由移动离子(H+和SO42-)的浓度增大,导电性会增强,与图像不符,错误;D、等体积等浓度的稀硫酸分别与足量铁和镁反应产生氢气的量相等,镁比铁活泼,镁先反应完,与图像不符,错误。
考点:以图像、图形为载体考查基本概念和相关物质的性质。
本题难度:一般
5、选择题 下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
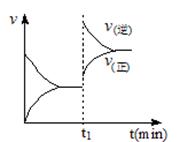
A.2SO2(g)+O2(g) 2SO3(g) △H<0 2SO3(g) △H<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0 4NO(g)+6H2O(g) △H<0
C.H2(g)+I2(g)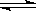 2HI(g) △H>0 2HI(g) △H>0
D.C(s)+H2O(g)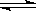 CO(g)+H2(g) △H>0 CO(g)+H2(g) △H>0
参考答案:B
本题解析:
试题分析:由图可知,改变一个条件后,平衡逆向移动,且反应速率加快。若是升高温度,则逆向是吸热反应,正向则是放热反应;若是增大压强,则逆向是气体的物质的量减小的方向,正向则是气体物质的量增大的方向,据此判断正向是放热且气体的物质的量增大的可逆反应符合此图,所以答案选B。
考点:考查对平衡图像的分析,化学平衡的移动理论的应用
本题难度:一般
|