微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3-
C.一定温度下,1L0.5mol·L-1NH4Cl溶液中与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同
D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存
参考答案:B
本题解析:
试题分析:A.常温下pH=7的溶液中:Fe3+、Mg2+会形成Fe(OH)3、Mg(OH)2沉淀析出,不能大量共存,错误;B.已知电离平衡常数:H2CO3>HClO>HCO3-,电离平衡常数越大,则酸性就越强,根据复分解反应的规律,强酸制取弱酸,所以向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3-,正确;C.NH4Cl是强酸弱碱盐,NH4+水解消耗,而且物质的浓度越大,水解程度就越小。一定温度下,1L0.5mol·L-1NH4Cl溶液中与2L0.25mol·L-1NH4Cl溶液由于前者水解程度小于后者,所以含NH4+物质的量前者大于后者,错误;D.常温下水电离出c(H+)×c(OH-)=10-20的溶液,说明水的电离受到了抑制,溶液可能显酸性也可能显碱性。在酸性溶液中:NH+、ClO-会发生反应形成HClO,不能大量共存,在碱性溶液中OH-、NH4+会发生反应形成NH3?H2O也不可能大量共存,错误。
考点:考查离子大量共存的知识。
本题难度:困难
2、选择题 将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是
A.c(HCN)>c(CN—)
B.c(Na+)>c(CN—)
C.c(HCN)-c(CN—)=c(OH—)
D.c(HCN)+c(CN—)=0.1mol/L
参考答案:C
本题解析:
试题分析:
将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,则
A.等浓度的CN-水解程度大于HCN电离程度,则c(HCN)>c(CN-),故A正确;
B.溶液显碱性,则c(OH-)>c(H+),根据c(Na+)+c(H+)=c(CN-)+c(OH-)可知,c(Na+)>c(CN-),故B正确;
C.根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),根据电荷守恒可知c(Na+)+c(H+)=c(CN-)+c(OH-),二者联式可得:c(HCN)-c(CN-)=2c(OH-)-2c(H+),故C不正确;
D.将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,根据物料守恒可知,c(HCN)+c(CN-)=2c(Na+),c(HCN)+c(CN-)=0.1mol?L-1,故D正确。
考点:溶液中离子浓度大小比较及物料守恒的应用
点评:本题考查了溶液中离子浓度大小比较及物料守恒的应用,难度中等。解题时应注意从题目所给的已知条件判断出CN-水解程度大于HCN电离程度,从而比较出离子浓度大小。
本题难度:一般
3、选择题 常温下,0.1 mol/LKCl溶液和0.1 mol/LCH3COOK溶液各100 mL,两溶液中所含离子总数
A.一样多
B.KCl溶液中多
C.CH3COOK溶液中多
D.无法比较
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
参考答案:B
本题解析:
试题分析:A项是电荷守恒,正确;NaOH是强碱,完全电离,CH3COONa和Na2CO3溶液是因为水解溶液显碱性,CO32-的水解程度比CH3COO-大,要pH相同,CH3COONa更大才行,B不正确;由电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)和物料守恒c(CH3COO-)+c(CH3COOH)=2c(HNa+)可得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),C正确;NaHA溶液的pH=4说明HA-的电离程度比水解程度大,D正确。
考点:溶液中的守恒规律的应用、电离和水解程度对溶液的酸碱性的影响。
本题难度:困难
5、填空题 常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:

(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
参考答案:(11分) (1)MOH=M+ + OH-(若写可逆号扣1分
本题解析:
试题分析:(1)根据图像可知,当加入13mlHA时,HA是过量的,但溶液显中性,这说明MOH一定是强碱,而HA是弱酸,则MOH在水溶液中的电离方程式为MOH=M+ + OH-。
(2)由于HA是弱酸,MOH是强碱,则MOH与HA恰好完全反应时,生成的MA水解,溶液呈碱性,水解方程式是A- + H2O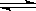 HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
(3)B点溶液显中性,则根据电荷守恒可知[M+]=[A-]>[H+]=[OH-]。
(4)D点溶液中的溶质是MA和HA,且二者的浓度是相等的,所以根据物料守恒可知,c(A-)+c(HA)=2 c(M+)。有电荷守恒可知c(A-)+c(OH-)=c(M+)+c(H+),则c(HA) + c(H+)=c(OH-)+ c(M+)=10-11+0.05。
考点:考查弱电解质的电离、盐类水解、溶液中离子浓度大小比较和有关计算
点评:该题是中等难度的试题,试题贴近高考,综合性强,试题基础性强,侧重能力的培养和解题方法的指导,主要是考查学生分析和解决问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确溶液中离子的几种守恒关系,即电荷守恒、物料守恒及质子守恒。
本题难度:困难