微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关沉淀溶解平衡的说法正确的是( )
A.KSP(AB2)小于KSP(CD),则物质AB2的溶解度一定小于物质CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
参考答案:A、因比较不同类型的难溶物的溶解度大小,必须通过计算溶解度比
本题解析:
本题难度:简单
2、填空题 (共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
?????????????????????????????????????????????????????????????????。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示):?????????????????????????????;??????????????????????????????;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
???????????????????????????????????????????????????????????????????。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入??????????????,目的是??????????????????????????????????????????????????????????;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
???????????????????????????????????????????????????????????????????。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) 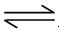 ?Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
?Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是????????????????????????(填写序号);②中氯离子的浓度为?????????????????mol·L-1
参考答案:(1)c(NH4+)> cSO42-)> c(H+)> c(
本题解析:略
本题难度:简单
3、实验题 (12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol·L-1 Na2C2O4溶液(过量)和25mL 6mol·L-1 HNO3溶液,在6070℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol·L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol·L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]。
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
参考答案:(1)pH≤8.5
(2)溶液变成浅红色,且半分钟内不
本题解析:
试题分析:(1)已知Mn(OH)2的Ksp=2.0×10-13=c(Mn2+)×c(OH-)2,c(OH-)= =
= mol/L, c(H+)=
mol/L, c(H+)= =
= ,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
(2)当溶液变成浅红色,且半分钟内不褪色时,说明到达了滴定终点;
(3)终点读数时俯视刻度时,会导致滴定结果偏大;
(4)样品溶解后,滴定消耗高锰酸钾:
10.00 mL×0.02000 mol·L-1="0.2000" mmol
2Mn2+---------------5C2O42-
0.2000 mmol 0.5000 mmol
样品溶解过程所消耗的C2O42-量:25.00 mL×0.06000 mol·L-1-0.5000 mmol="1.000" mmol
La2Ca2MnOx中Mn的化合价为(2x-10) ,La2Ca2MnOx中锰得电子数与C2O42-失电子数 相等:
 ×(2x-10-2)=2×1.000×10-3 解得:x=7
×(2x-10-2)=2×1.000×10-3 解得:x=7
考点:滴定终点的判断,滴定的相关计算,pH的计算
本题难度:困难
4、选择题 硫酸锶(SrSO4)在水中的溶解平衡曲线如图。下列说法正确的是( )

A.温度一定时,Ksp(SrSO4)随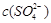 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时a点对应的溶液是不饱和溶液
D.283K下SrSO4饱和溶液升温到363K后变为不饱和溶液
参考答案:BC
本题解析:溶度积常数只与温度有关,A错误。根据图像可判断,当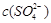 相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当
相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当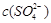
本题难度:简单
5、选择题 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为 ( )
A.只有AgBr沉淀
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
参考答案:C
本题解析:
试题分析:在AgCl和AgBr两饱和溶液中,前者c(Ag+?)大于后者c(Ag+?),c(Cl-?)>c(Br-?)。当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化:生成AgBr沉淀。当加入足量的浓?AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多。
点评:本题考查难溶电解质的溶解平衡,题目难度适中,可根据课本知识进行解答。
本题难度:简单