微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
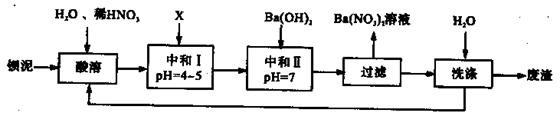
又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;?
③KSP(BaSO4)=1.lxl0-10,? KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:______________???????????????????????????????????????????????。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
?????????????????????????????????????????????????????????????????????????。
(3)该厂结合本厂实际,选用的X为????????????????(填序号);
A.BaCl2
B.BaCO3
C.Ba(NO3)2
D.Ba(OH)2
(4)中和I使溶液的pH为4~5目的是????????????????????????????????????????????;
结合离子方程式简述原理????????????????????????????????????????????????????????。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是????????????????????????????????。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为??????????????。
参考答案:(1)BaSO4(S)+CO32-(aq) ![]()
本题解析:
试题分析:(1) BaSO4沉淀在饱和Na2CO3溶液中转化为BaCO3,离子方程式为BaSO4(S)+CO32-(aq)  BaCO3(S)+SO42-(aq);(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,分别为Ba(NO3)2和Fe(NO3)2;方程式为Ba(FeO2)2+8HNO3=Ba(
BaCO3(S)+SO42-(aq);(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,分别为Ba(NO3)2和Fe(NO3)2;方程式为Ba(FeO2)2+8HNO3=Ba(
本题难度:困难
2、选择题 在常温时的下列溶液中,BaSO4的溶解度最大的是
[? ?? ]
A.40?mL?1?mol/L的BaCl2溶液
B.30?mL?2?mol/L的Ba(OH)2溶液
C.10?mL纯水
D.50?mL?0.1?mol/L的H2SO4溶液
参考答案:C
本题解析:
本题难度:一般
3、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是
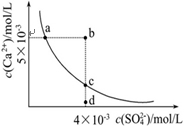
常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出????
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
参考答案:D
本题解析:A、常温下CaS04 91exam .org饱和溶液中,c(Ca2+)?c(SO42-)=Ksp,Ksp(CaS04)=9×l0-6,c(Ca2+)=c(SO42-)=3×l0-3,故A错误;
B、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,不一定等于3×l0-3mol/L,故B错误;
C、升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,故C错误;
D、a、c点均是常温下CaS04在水中的沉淀溶解
本题难度:一般
4、填空题 对于难溶盐MX,若饱和溶液中M+和X-的物质的量 浓度之间的关系类似于c(H+)·c(OH-)= KW,存在等式 c(M+)·c(X-)= Ksp。现将足量的AgCl分别放入下列溶液中,AgCl的溶解的量由大到小的排列顺序是________。
①20mL 0.O1mol/L KCl溶液
②30mL 0.02mol/L CaCl2溶 液
③40mL 0.03mol/L HCl溶液
④10mL蒸馏水
⑤50mL0.05 mol/L AgNO3溶液
参考答案:④①③②⑤
本题解析:
本题难度:一般
5、填空题 四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+
参考答案:
本题解析:
本题难度:困难