微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是 [???? ]
A.一定条件下,催化剂能加快反应速率,也能提高反应物的平衡转化率
B.电解从海水中得到的氯化镁溶液可获得金属镁
C.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用盐酸溶解除去
D.反应NH3(g)+HCl(g)=NH4Cl(s) △H<0在高温下能自发进行
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法正确的是[???? ]
A.CO燃烧产生蓝色火焰;氢气燃烧产生淡蓝色火焰
B.化学反应速率的单位可以写成“mol/L·min”或 “mol/L·s”
C.某溶液中离子沉淀完全意味着该离子浓度为0 moL/L
D.做实验时剩余的试剂均不能放回原试剂瓶中
参考答案:A
本题解析:
本题难度:简单
3、选择题 已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是

A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大

B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大

C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01 mol·L-1NH4Cl溶液中的Ksp小

D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
参考答案:B
本题解析:氢氧化镁的溶度积常数小于氟化镁的,所以A不正确。由于氯化铵溶于水,电离出NH4+能结合溶液中OH-,促进氢氧化镁的溶解,B正确。溶度积常数只与温度有关系,C不正确。只要溶液中c(Mg2+)·c2(OH-)>KSP[MgF2],就会有氟化镁沉淀析出,D不正确。答案选B。
本题难度:简单
4、实验题 (14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
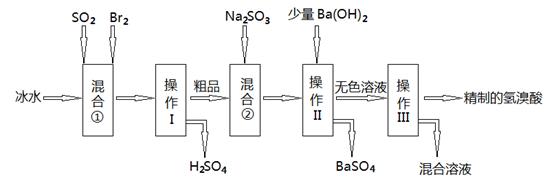
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )
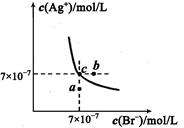
A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816
参考答案:(每空2分)
(1)降低体系的温度,防止溴的挥发(2分
本题解析:
试题分析:(1)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全。
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏。
(3)混合②中加入Na2SO3,Na2SO3具有还原性,被Br2氧化,所以离子方程式为:Br2+SO32-+H2O=2Br-+SO42-+2H+
(4)目的是制取CaBr2,通过控制溶液的PH约为8.0即可除去杂质Al3+、Fe3+,为了防止新杂质的进入,应加入含Ca元素且能与H+反应的物质,如CaO或Ca(OH)2或CaCO3;控制溶液的PH约为8.0时,Al3+、Fe3+转为Al(OH)3和Fe(OH)3沉淀而除去,所以控制溶液的PH约为8.0的目的是确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解。
(5)A、根据图中c点坐标可求出AgBr的Ksp=7×10-7×7×10-7= 4.9×10-13,小于AgCl的Ksp,但选项中没有给出Cl?和Br?浓度,所以不一定先产生AgBr的沉淀,错误;B、在AgBr饱和溶液中加入NaBr固体,沉淀溶解平衡移动后溶液仍为饱和溶液,不可能由c点到b点,错误;C、a点在溶解平衡曲线以下,所以a点对应的是AgBr的不饱和溶液,正确;D、在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl?)/c(Br?)= c(Cl?)?c(Ag+)/c(Br?) ?c(Ag+)="Ksp(AgCl)/" Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl?)/c(Br?)= c(Cl?)?c(Ag+)/c(Br?) ?c(Ag+)="Ksp(AgCl)/" Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
考点:本题考查化学流程的分析、基本操作、除杂、沉淀溶解平衡。
本题难度:一般
5、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA-? HA-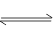 H++A2-?????完成以下问题:
H++A2-?????完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32-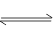 CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=????(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=????(计算结果保留三位有效数字)
参考答案:(1) 碱性?? B2-+H2O  本题解析:
本题解析:
试题分析:二元酸(化学式用H2A表示)在水中的电离方程式是:H2A==H++HA-? HA-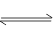 H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O  本题难度:一般
本题难度:一般