微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,可逆反应2NO2(g)? ?2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是??????????? ( )
?2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是??????????? ( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥
B.①②③⑤
C.②③④⑥
D.以上全部
参考答案:A
本题解析:①生成n mol O2,就是消耗2n mol NO2,即生成NO2的速率等于消耗NO2的速率,能表示v正=v逆,正确。②表示同一方向的反应速率,不能表示v正=v逆,不正确。③只要发生反应,或者说不论反应是否达到平衡,NO2、NO、O2的速率之比就为2∶2∶1,它不能反映可逆反应是否达到平衡,不正确。④温度、体积一定,混合气体压强不再改变,对于反应前后气体体积不相等的反应,说明气体的总物质的量不变,表明已达平衡。⑤颜色的深浅决定于有色物质NO2的浓度,混合气体颜色不变,说明NO2的浓度不再改变,能说明已达到平衡,正确。⑥混合气体的平均相对分子质量(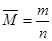 ?)不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
?)不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
本题难度:一般
2、计算题 (6分)一定温度下,在2L密闭容器中充入N2和H2合成NH3,其起始浓度分别为:c(N2)=2mol/L,c (H2 ) =3mol/L,此时压强为5.05×105Pa, 达平衡后测得NH3占总体积的25%。(1)求平衡时的压强;(2)平衡时混合气体对H2的相对密度。???
参考答案:(1) 4.04 ×105?Pa????(2)7.75
本题解析:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
4mol?? 6mol???????? 0
a???? 3a????????????? 2a
4--a???? 6---3a?????????? 2a
2a/(10-2a)×100%=25%??? a==1mol
P1:P2===N1:N2????P1==5.05×105Pa??
N1==10mol???????????N2==8mol???? P2==4.04×105Pa
M混==(4mol ×28g/mol+ 6mol ×2g/mol)/8mol ===15.5g/mol
D====7.75
本题难度:一般
3、选择题 (2013?吉林模拟)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂
参考答案:B
本题解析:提高CO的转化率可以使平衡正向进行,根据化学平衡移动原理来回答判断.
解:提高CO的转化率可以让平衡正向进行即可.
A、增加压强,该平衡会不会发生移动,故A错误;
B、降低温度,化学平衡向着放热方向即正向进行,故B正确;
C、增大CO的浓度,化学平衡向着正方向进行,但是一氧化碳的转化率降低,故C错误;
D、催化剂不会引起化学平衡的移动,故D错误.
故选B.
点评:本题考查学生化学平衡移动原理的应用方面的知识,属于基本知识的考查,注意知识的积累是解题的关键,难度不大.
本题难度:一般
4、填空题 已知水在25 ℃和95 ℃时,其电离平衡曲线如右图所示:
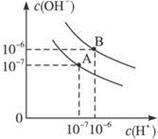
⑴则25 ℃时水的电离平衡曲线应为? ___?(填“A”或“B”),请说明理由????????? ________________?????????。
⑵95 ℃时PH=2的NaOH溶液中由水电离的c(H+) ______。
⑶25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为? _________?。
⑷25 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是? _____?。
⑸曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析原因:????????????。
⑹95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则c(NH4+)______c(Cl-)(填“>”、“<”、或“=”)
参考答案:(14分)⑴①A(2分)②水的电离是吸热过程,温度低时,电离
本题解析:
试题分析:(1)电离是吸热,则升高温度,电离程度增加,水中氢离子浓度增加,所以25 ℃时水的电离平衡曲线应为A。
(2)95 ℃时水的离子积常数是10-12,所以pH=2的NaOH溶液中由水电离的c(H+)=10-10mol/L。
(3)若所得混合溶液的pH=7,则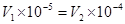 ,解得
,解得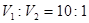 。
。
(4)若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则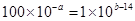 ,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
,所以该强酸的pH1与强碱的pH2之间应满足的关系是a+b=16或pH1+pH2=16。
(5)曲线B对应95 ℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
(6)95 ℃时,某氨水与氯化铵的混合溶液的PH=7,则溶液显碱性。所以根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+c(Cl-),c(NH4+)>c(Cl-)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确随着温度的升高,水的离子积常数是增大,在计算pH时需要灵活运用。
本题难度:一般
5、填空题 已知T K和P kPa时,在容积为V L的密闭容器中充有1 mol A和1 mol B,保持恒温恒压,使反应: A(g)+B(g) C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
C(g)达到平衡时, C的体积分数为40%。试完成下列有关问题:
(1)若使温度和压强在上述条件下恒定不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时,容器的体积为________,C的体积分数为________。
(2)若另选一容积固定不变的密闭容器,仍然控制温度为T K,使1 mol A和1 mol B反应达到平衡状态时, C的体积分数仍然为40%,则该密闭容器的体积为________。
参考答案:(1) 本题解析:恒温恒压时保持某物质成分的体积分数不变,允许所有的物质成倍改变,所加入物质成倍改变后,平衡状态时体系的体积也成倍改变,所以先计算出加入1 mol A和1 mol B后达到平衡状态时体系的体积为
本题解析:恒温恒压时保持某物质成分的体积分数不变,允许所有的物质成倍改变,所加入物质成倍改变后,平衡状态时体系的体积也成倍改变,所以先计算出加入1 mol A和1 mol B后达到平衡状态时体系的体积为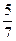 V L,则当加入2 mol A和2 mol B时达到平衡状态后体系的体积必然为
V L,则当加入2 mol A和2 mol B时达到平衡状态后体系的体积必然为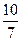 V L。当反应在固定体积的容器中反应时,只有一开始体积就是平衡状态时的体积,才能满足平衡时C的体积分数不变。
V L。当反应在固定体积的容器中反应时,只有一开始体积就是平衡状态时的体积,才能满足平衡时C的体积分数不变。
本题难度:简单