微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O时,放出445KJ热量,则下列热化学方程式正确的是( )
A:2 CH4 (g)+4O2(g)=2CO2(g) +4H2O(l) △H=+890KJ/mol
B:CH4 +2 O2=CO2+2H2O △H=-890KJ/mol
C:CH4 (g)+ 2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol
2O2(g)=CO2(g) +2H2O(l) △H=-890KJ/mol
D: CH4 (g)+O2(g)= CO2(g) +H2O(l) △H=-890KJ/mol
参考答案:C
本题解析:略
本题难度:一般
2、填空题 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ?mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ?mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ?mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)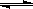 N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min)
浓度(mol/L)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
|
N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)根据盖斯定律,反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)可有方程式(1)×1/2+(2)得,因此代入相对应焓变值,得a/2+b;(2)①0~10min内,NO的平均反应速率v(NO)=(1-0.68)/10=0.032 mol/(L·min),T1℃时,在20min时各组分浓度不再发生变化,说明反应达到平衡,可得平衡常数为(0.25×0.25)/0.52=0.25;②30min后,只改变某一条件,反应重新达到平衡,各组分浓度都增加,可能是缩小体积或增加NO,加入碳是固体,或加入催化剂,平衡不移动,因此选ad;③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,相对原来的2:1:1,平衡向左移动,NO的量增加,根据升高温度,平衡向吸热反应方向移动,正反应是放热反应,Q<0,④在恒容绝热条件下,能判断该反应一定达到化学平衡状态,a.单位时间内生成2nmol NO(g),反应向逆反应方向进行,消耗nmol CO2(g),也是向逆向进行,不能表示平衡,错误;b.反应体系的温度不再发生改变,因为是绝热体系,所以当温度不再改变时,表示达到平衡,正确; c.混合气体的密度不再发生改变,体积不变,但碳是固体,当气体质量不再改变时,也就是密度不变,达到平衡,正确。
考点:考查盖斯定律、化学反应原理
本题难度:困难
3、选择题 已知:①2H2(g)+O2(g)=2H2O (g) △H1
②3H2(g)+Fe2O3(s)=2Fe(s)+3H2O (g) △H2
③2Fe(s)+3/2O2(g)=Fe2O3(s) △H3
④2Al(s)+3/2O2(g)=Al2O3(s) △H4
⑤2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1<0,△H3>0
B.△H5<0,△H4<△H3
C.△H1=△H2+△H3
D.△H3=△H4+△H5
参考答案:B
本题解析:
试题分析:A、反应2Fe(s)+3/2O2(g)=Fe2O3(s)为放热反应,△H3<0,错误;B、反应2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)为放热反应,△H5<0,铝比铁活泼,具有的能量高,等量的铝与氧气反应放出的热量比等量的铁多,△H4<△H3,正确;C、根据盖斯定律:①=(②+③)×2/3,△H1=(△H2+△H3)×2/3,错误;根据盖斯定律:③=④—⑤,△H3=△H4—△H5,错误。
考点:考查化学反应的热效应,盖斯定律。
本题难度:一般
4、选择题 已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)==="2CO(g)" ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A.ΔH1>0, ΔH3<0
B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5
参考答案:C
本题解析:
试题分析:C燃烧为放热反应故ΔH1<0故A项错误;CO燃烧放热故ΔH3<0,则B项错误;根据盖斯定律可知ΔH2=ΔH1—ΔH3,则ΔH1=ΔH2+ΔH3,故C项正确;ΔH5= ΔH3- ΔH3- ΔH4,故D项错误。 ΔH4,故D项错误。
考点:反应能量变化及盖斯定律应用。
本题难度:一般
5、填空题 (1)北京奥运会“祥云”火炬用的是环保型气体燃料-丙烷(C3H8),已知0.1mol丙烷完全燃烧生成CO2气体和液态水放出的热量为222.15kJ,则丙烷燃烧的热化学方程式为______.
(2)在生物质能利用过程中,可将含糖类、淀粉[(C6H10O5)n]较多的农作物为原料在催化剂作用下,经水解和细菌发酵可以制得酒精(C2H5OH),它和汽油混合作为汽车的燃料.写出由淀粉制酒精的两步主要反应的化学方程式:______、______.
参考答案:(1)0.1mol丙烷完全燃烧放出222.15kJ,则1mo
本题解析:
本题难度:一般
|