微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸盐在生产生活中有广泛应用。
Ⅰ.工业上以重晶石(主要成分BaSO4)为原料制备BaCl2,其工艺流程示意图如下:

某研究小组查阅资料得:
BaSO4(s)+4C(s) 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
2CO2(g)+BaS(s)△H2=+226.2kJ?mol-1 ②
(1)用过量NaOH溶液吸收气体,得到硫化钠。该反应的离子方程式是 。
(2)反应C(s)+CO2(g) 2CO(g)的△H= 。
2CO(g)的△H= 。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的有两个
①从原料角度看, ;
②从能量角度看,①②为吸热反应,炭和氧气反应放热维持反应所需高温。
(4)该小组同学想对BaSO4在水中的沉淀溶解平衡做进一步研究,查资料发现在某温度时BaSO4在水中的沉淀溶解平衡曲线如图所示。

该小组同学提出以下四种观点:
①当向含有SO42-的溶液中加入Ba2+ 使SO42-沉淀完全,则此时SO42-在溶液中的浓度为0
②加入Na2SO4可以使溶液由a点变到b点
③通过蒸发可以使溶液由d点变到c点
④d点无BaSO4沉淀生成
其中正确的是 (填序号)。
Ⅱ.某燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2
参考答案:
本题解析:
本题难度:困难
2、选择题 工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应.现将2mol?SO2、1mol?O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则下列热化学方程式正确的是( ? )
A.2SO2(g)+O2(g)?2SO3(g)△H=-196.6?kJ?mol-1
B.2SO2(g)+O2(g)?2SO3(g)△H=-98.3?kJ?mol-1
C.SO2(g)+1/2O2(g)?SO3(g)△H=+98.3?kJ?mol-1
D.SO2(g)+1/2O2(g)?SO3(g)△H=+196.6?kJ?mol-1
参考答案:A
本题解析:
本题难度:简单
3、填空题 工业制备白磷(P4)的方法很多,其中用得较多的方 法是以磷矿粉[Ca3(PO4)2]、焦炭(C)、石英砂(SiO2)为原料 制备白磷,其生产过程示意图如下: 请回答下列问题:

(1)试写出该法制备白磷的化学方程式:________________。
(2)已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1;Cl-Cl b kJ·mol-1;P-Cl c kJ·mol-1。则反应: P4(s)+6Cl2(g)=4PCl3 (1) △H=_________。
(3)化学反应在反应物到生成物的过程中需经过一个高能量的过渡态(如图I),已知红磷的化学式为P,红磷和白磷充分 燃烧后的产物均为P4O10(温度高于300℃时易升华)。

①表示白磷燃烧热的热化学方程式为____。
②结合图I、Ⅱ分析,1 mol红磷完全转化为白磷,需____(填“吸收”或“放出”)的热量为______kJ。
参考答案:(1) 2Ca3(PO4)2+6SiO2+10C![]()
本题解析:
本题难度:一般
4、简答题 过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
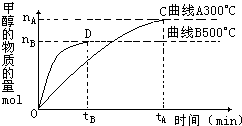
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
nA
tA
mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,n(H2)
n(CH3OH)
增大
(3)25℃,1.01×105Pa时,16g?液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
参考答案:(1)根据K=生成物的浓度幂之积除以反应物的浓度幂之积,得出
本题解析:
本题难度:一般
5、选择题 根据以下三个热化学方程式:
(1)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH= -Q1kJ·mol-1
(2)2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH= -Q2kJ·mol-1
(3)2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH= -Q3kJ·mol-1
判断 三者关系正确的是 三者关系正确的是
A.Q1>Q2>Q3
B.Q1>Q3>Q2
C.Q3>Q2>Q1
D.Q2>Q1>Q3
参考答案:B
本题解析:
试题分析:硫化氢燃烧得到二氧化硫和水比燃烧得到硫单质和水时氧化程度高释放的热量多。所以Q1>Q2;Q1>Q3,气态水比液态水含有的能量高,所以放热(3) >(2).即Q3>Q2。所以三者关系是:Q1>Q3>Q2。选项为:B。
考点:考查反应热与氧化程度、物质的状态等关系的知识。
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772