微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)下列实验的操作或所用的试剂有错误的是
A.实验室制取乙烯气体时,将温度计的水银球放入液面以下
B.可用酒精洗涤沾有苯酚的试管
C.证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水
D.配制银氨溶 液时,将硝酸银
液时,将硝酸银 溶液逐滴滴入氨水中
溶液逐滴滴入氨水中
E.苯中混有苯酚,加浓溴水,然后分液
F、用浓氨水洗涤做过银镜反应的试管
参考答案:DEF
本题解析:略
本题难度:一般
2、计算题 (10分)某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量
| 剩余固体质量
|
第一次加入10g
| mg
|
第二次加入10g
| 2.0g
|
第三次加入10g
| 1.5g
|
第四次加入10g
| 1.0g
|
第五次加入10g
| 0.6g
|
第六次加入10g
| 0.6g
(1)从以上数据可知,最后剩余的0.6g固体的成分是??????;这六次实验中,第???次加入稀硫酸时样品中的镁已经完全反应;表格中,m=???????。
(2)计算合金样品中镁的质量分数。
(3)计算所用稀硫酸中H2SO4的质量分数。
参考答案:(1) Cu (1分)?? 5? (1分)?? 2.5 (1
本题解析:(1)铜和稀硫酸不反应,所以最后剩余的是铜。根据实验2、3可知,10g稀硫酸就能溶解0.5g合金。所以m=3g-0.5g=2.5g。在实验4、5中溶解的合金质量是0.4g,这说明在第5次加入稀硫酸时样品中的镁已经完全反应.
(2)铜是0.6g,所以镁是2.4g,则镁的质量分数是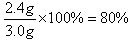
(3)10g稀硫酸就能溶解0.5g镁,所以根据方程式Mg+H2SO4=MgSO4+H2↑,10g稀硫酸中含有溶质是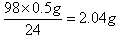 ,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。 ,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。
本题难度:一般
3、实验题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下
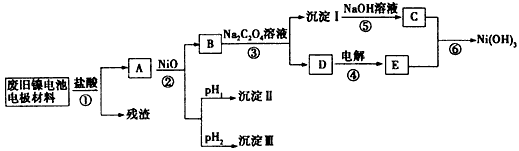
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示

请回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅲ:____(填化学式),则pH1____pH2(填“>”“=”或“<”),控制两种沉淀析出可利用_______________。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是_____________。第③步反应后,过滤沉淀I所需的玻璃仪器有_____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出 两种可能的原因:______________、______________。
(3)④中阳极反应产生的气体E为________,验证该气体的试剂为____________。
(4)试写出⑥的离子方程式:____________________。
参考答案:(1)Fe(OH)3;Al(OH)3;<;C
本题解析:
本题难度:一般
4、简答题 某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
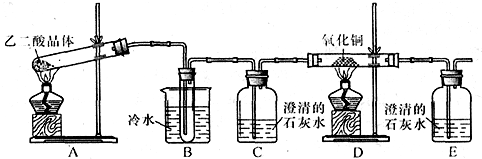
查阅资料可知:乙二酸晶体(H2C2O4?2H2O)熔点100.1℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:______;
(2)装置B的作用是______;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是______;______.
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是______.
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物.实验小组进一步探究:①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是______.②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L.则红色固体中含单质铜的质量分数是______.
参考答案:(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色
本题解析:
本题难度:一般
5、选择题 根据下列实验设计及有关现象,所得结论不正确的是
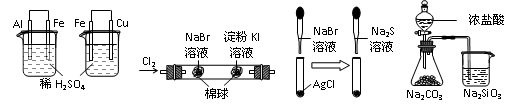
A???????????????????B??????????????C????????????????D
实 验
| 实验现象
| 结 论
| A
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
| 活动性:Al>Fe>Cu
| B
| 左边棉花变为橙色,右边棉花变为蓝色
| 氧化性:Cl2>Br2>I2
| C
| 白色固体先变为淡黄色,后变为黑色(Ag2S)
| 溶解性 :AgCl>AgBr>Ag2S
| D
| 锥形瓶中有气体产生,烧杯中液体变浑浊
| 酸性:HCl>H2CO3>H2SiO3
参考答案:BD
本题解析:
答案:BD
B、右边棉花变为蓝色,发生的反应有两种可能:Cl2+2I―=2Cl―+I2? Br2+2I―=2Br―+I2
D、烧杯中液体变浑浊,也可能是2HCl+Na2SiO3=H2SiO3+2NaCl.
本题难度:简单
|
|