微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应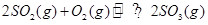 ,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是???????????
,从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是???????????
A.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D.若所采取的措施是缩小容器的容积,则新平衡SO2和O2转化率之比和旧平衡中SO2和O2的转化率之比都是1∶1
参考答案:A
本题解析:
A项,SO2和O2减少的物质的量之比为2∶1,所以新平衡体系中,SO2和O2物质的量之比仍为2∶1,故A正确;B项,逆反应速率也可能增加,只是比正反应速率增加的少,错误;C项,把SO3移走一些,可以导致SO2和O2又消耗了一些,并再次达到平衡,此时SO3的浓度减少,错误;D项若所采取的措施是缩小容器的容积,平衡向正反应方向移动,SO2和O2转化率增大,之比大于1,错误。
本题难度:一般
2、选择题 一定条件下,在体积为10L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)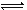 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(???? )
Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是(???? )
A.60s里以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的DH>0
参考答案:A
本题解析:经60s达到平衡,生成0.3 mol Z,所以用Z表示的反应速率为
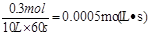 。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
。因为速率之比是相应的化学计量数之比,所以以X浓度变化表示的反应速率为以X浓度变化表示的反应速率为0.0005 mol/(L·s)×2=0.001 mol/(L·s),A正确。增大容器的体积,压强减小,平衡向逆反应方向移动,所以Z的平衡浓度小于原来的1/2,B不正确。增大压强,平衡向正反应方向移动,反应物的转化率增大,C不正确。升高温度,X的体积分数增大,说明平衡向逆反应方向移动,所以正反应是放热反应,D不正确。答案选A。
本题难度:简单
3、选择题 增大压强,对已达到平衡的下列反应产生的影响是
3X(g)+Y(g)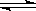 2Z(g)+2Q(s)
2Z(g)+2Q(s)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
参考答案:C
本题解析:考查外界条件对化学平衡的影响。该反应是体积减小的可逆反应,因此最大压强正反应速率和逆反应速率均增大,但正反应速率增大的趋势大于逆反应速率的,所以平衡向正反应进行,故正确的答案是C。
本题难度:简单
4、填空题 在温度为830 K时,下列可逆反应及其平衡具有某些特殊性,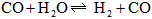 若起始浓度
若起始浓度
[CO]为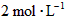 、[
、[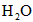 ]为
]为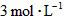 ,反应达平衡时,
,反应达平衡时,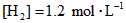 ;如果[CO]不变而将
;如果[CO]不变而将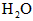 的起始浓度加大到
的起始浓度加大到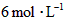 。则平衡时
。则平衡时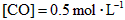 。
。
请注意上述有关数据,总结出其中的规律,根据此规律,填写以下空白:
设830 K时,起始浓度[CO]为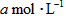 ,[
,[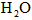 ]为
]为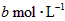 ,反应达平衡时[
,反应达平衡时[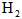 ]为
]为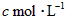
(1)当b不变,a减小,重新达平衡时,CO的转化率________,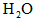 的转化率________(均填“提高”、“降低”或“不变”)
的转化率________(均填“提高”、“降低”或“不变”)
(2)当a=5,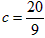 时,b=________;
时,b=________;
(3)当a=b时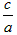 =________;
=________;
(4)当b=4,c=2时,a= _________;
(5)用以表示a、b、c之间关系的代数式为:_________。
参考答案:(1)提高;降低
(2)4
(3)0.5
本题解析:
本题难度:一般
5、选择题 为了检验新型镍催化剂在不同温度下对苯催化加氢的影响。其他条件相同,定时取样分析成分:
温度/℃
| 85
| 90
| 95
| 100
| 200
| 280
| 300
| 320
| 340
|
苯(mmol)
| 96.05
| 91.30
| 91.55
| 80.85
| 10
| 23.35
| 36.90
| 55.99
| 72.37
|
环己烷
(mmol)
| 3.95
| 8.7
| 8.45
| 19.15
| 90
| 76.65
| 63.10
| 44.01
| 27.63
(采用微型反应装置,压强为0.78 MPa,氢、苯物质的量之比为6.5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.通过改变温度或压强不能使氢气和苯的转化率相同
C.调控压强与氢、苯物质的量之比可能有利于提高苯的转化率
D.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
参考答案:D
本题解析:根据表中数据的变化趋势看,AC正确。温度或压强会影响化学平衡,B正确。若正反应吸热,则温度升高有利于提高转化率,即该反应应是放热反应,D不正确。
本题难度:一般
|