微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L?·min),则此段时间内以C的浓度变化表示的化学反应速率为
A.0.5 mol/(L ·min)
B.1 mol/(L ·min)
C.2 mol/(L ·min)
D.3 mol/(L ·min)
参考答案:C
本题解析:由于反应速率之比是相应的化学计量数之比,所以根据A的反应速率可知,此段时间内以C的浓度变化表示的化学反应速率为1mol/(L ·min)×2=2 mol/(L ·min),所以正确的答案选C。
本题难度:困难
2、填空题 工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式???????????????????????????????????;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是????(填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
SO2
| O2
| SO2
| O2
|
1
| T1
| 4
| 2
| x
| 0.8
| 6
|
2
| T2
| 4
| 2
| 0.4
| y
| t
?
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为??????????????;
T1??????T2 (选填“>”、“<”或“=”),理由是??????????????????????????????。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-)之比为??????????。
该溶液中c(OH—)= c(H+)+ ????????+ ????????(用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 ????????(用编号排序)
A.Na2SO3???????B.Ba(NO3)2 ???????C.Na2S?????? D.酸性KMnO4
参考答案:(1)K=[SO3]2/([SO2]2[O2])
(2
本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知其平衡常数表达式为K=[SO3]2/([SO2]2[O2])。
(2)a、反应速率υ正(O2)=2υ逆(SO3)不能满足反应速率之比是相应的化学计量数之比,因此不能说明该可逆反应已达到平衡状态,a不正确;b、保持温度和容器体积不变,充入2 mol N2,物质的浓度不变,则化学反应速率不变,b不正确;c、平衡后移动活塞压缩气体,压强增大平衡向正反应方向移动,所以平衡时SO2、O2的百分含量减小,SO3的百分含量增大,c正确;D、正方应是放热反应,则平衡后升高温度,平衡向逆反应方向移动,所以平衡常数K减小,d不正确,答案选c。
(3)根据表中数据可知平衡时氧气的物质的量减少2mol-0.8mol=1.2mol,则根据反应式可知生成三氧化硫2.4mol,其浓度为2.4mol÷2=1.2mol/L,所以用三氧化硫表示的反应速率为1.2mol/L÷6min=0.2mol/(L· min)。X=4mol-1.2mol×2=1.6mol,而在t2时二氧化硫的平衡量是0.4mol,这说明t2时二氧化硫的转化率高。由于正方应是放热反应,所以降低温度才有利于SO2的转化,所以T1>T2。
(4)pH约为8,因此溶液中c(OH-)=10-6mol/L,溶液中钠离子浓度为0.2mol/L,所以该溶液中c(Na+)与c(OH-)之比为0.2mol/L ÷10-6mol/L =2×105 。根据质子守恒可知该溶液中c(OH—)=c(H+)+ c(HSO3-)+2c(H2SO3)。
(5)A、Na2CO3吸收二氧化硫发生的反应为:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑,1molNa2CO3最多吸收二氧化硫2mol;B、Ba(NO3)2?吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;C、Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;D、酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;计算分析吸收二氧化硫理论吸收量由多到少的顺序是B>C=D>A,故答案为:B>C=D>A。
本题难度:困难
3、选择题 在恒温下的定容密闭容器中,有可逆反应2NO(g)+O2(g) 2NO2(g),不能说明该反应已达到平衡状态的是 2NO2(g),不能说明该反应已达到平衡状态的是
A.混合气体的颜色不再变化
B.反应器中的压强不随时间的变化而变化;
C.混合气体中NO2的体积分数保持不变;
D.生成NO2的速率与生成O2的速率相等;
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以C能说明。颜色深浅和浓度有关系,所以A能说明。反应是体积减小的,因此压强也是减小的,B能说明。①中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明。答案选D。
本题难度:一般
4、选择题 对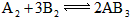 反应来说,以下反应速度的表示,最快的是[???? ] 反应来说,以下反应速度的表示,最快的是[???? ]
A.
B.
C.
D.无法判断
参考答案:A
本题解析:
本题难度:简单
5、选择题 一定温度下,浓度均为1mol/L的A2和B2两种气体,在密闭容器内反应生成气体C,达平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L,则该反应的正确表达式为( )
A.2A2+B2?2A2B
B.A2+B2?2AB
C.A2+B2?A2B2
D.A2+2B2?2AB2
参考答案:开始A2和B2两种气体的浓度均为1mol/L,在密闭容器内反
本题解析:
本题难度:简单
|