微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下在密闭容器中发生如下反应: 2A(g)+ B(g) 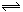 2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为(???)
2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为(???)
A.20%
B.40%
C.60%
D.80%
参考答案:C
本题解析:通入2molC与通入2molA和1molB是等效平衡。压强之比等于物质的量之比,物质的量增加2mol×20%=0.4mol故生成A0.8mol。如从正向反应,反应A为1.2mol,转化率为=60%
本题难度:一般
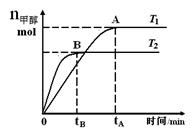
2、选择题 在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)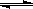 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如右图所示,下列说法正确的是
A.平衡常数K = 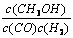
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下 的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
参考答案:D
本题解析:
试题分析:A、根据题给反应知,该反应的平衡常数K =c(CH3OH)/c(CO)c2(H2) ,错误;B、由题给图像可知,温度为T1时,平衡时甲醇的物质的量比T2时大,故该反应在T1时的平衡常数比T2时的大,错误;C、影响反应速率的外界因素有温度,故任意时刻,T2温度下的反应速率均大于T1温度下的速率,错误;D、由题给图像知,处于A点的反应体系从T1变到T2,平衡逆向移动,达到平衡时 增大,正确。
增大,正确。
本题难度:一般
3、选择题 在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:
A(气)+xB(气)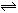 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为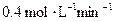
参考答案:BC
本题解析:略
本题难度:一般
4、选择题 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1℃时,将9 mol CO2和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是(??)
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是(??)

A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.42,则T2>T1
C.在T1℃,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强p=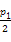
参考答案:D
本题解析:若增大压强,速率加快,平衡右移,则CH3OH的物质的量增加,A对;由图知,T1℃下达平衡时CH3OH为3 mol,则容器内CO2为6 mol、H2为3 mol、H2O为3 mol,各物质的平衡浓度:CO2为2 mol/L、H2为1 mol/L、H2O为1 mol/L、CH3OH为1 mol/L,求得平衡常数为0.5,因该反应正向放热,故升温逆向移动,平衡常数减小,所以,若T2℃时平衡常数为0.42,则T2>T1,B对;在T1℃,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),Q=0.36<0.5,故正向进行,达平衡前v(正)>v(逆),C对;在T1℃,两种投料方式中若反应物的转化率相等,则p=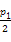 ,但是由于该反应是气体分子数减小的反应,故起始加入反应物的物质的量少的,其转化率小,故p>
,但是由于该反应是气体分子数减小的反应,故起始加入反应物的物质的量少的,其转化率小,故p>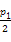 ,D错。
,D错。
本题难度:一般
5、简答题 设在某温度时,在容积为1L的密闭容器内,把氮气和氢气两种气体混合,反应后生成氨气.实验测得,当达到平衡时,测得氮气和氢气的浓度各为2mol/L,该温度下的平衡常数为0.5625则
(1)平衡时氨气的浓度为______
(2)求起始加入氮气的浓度
(3)反应前混合气体的平均分子量.
参考答案:达到平衡时,测得氮气和氢气的浓度各为2mol/L,该温度下的
本题解析:
本题难度:一般