微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式错误的是( )
A.K2CO3═2K++CO32-
B.KClO3═K++Cl-+3O2-
C.NaOH═Na++OH-
D.NaHCO3═Na++HCO3-
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是
A.AgCl 悬浊液中加入 KI 溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)<Ksp(AgI)
B.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的 pH 会增大
D.强电解质的水溶液中不存在分子
参考答案:B
本题解析:
试题分析:A、沉淀易向更难溶的方向转化,AgCl 悬浊液中加入 KI 稀溶液,白色沉淀变成黄色,证明此条件下 Ksp(AgCl)>Ksp(AgI) ,错误;B、水的离子积常数影响因素为温度,在纯水中加入强碱溶液,温度不变,水的离子积常数不变,正确;C、氢氧化钙的溶解度随温度的升高而降低,饱和石灰水中加入一定量生石灰,温度明显升高,氢氧化钙溶液的浓度降低,所得溶液的氢氧根浓度减小, pH 减小,错误;D、强电解质的水溶液中全部电离,水溶液中不存在强电解质分子,但存在溶剂水分子,错误。
考点:考查溶液中离子平衡。
本题难度:一般
3、选择题 一只50mL酸式滴定管盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL
B.为40.0 mL
C.大于10.0 mL
D.为10.0mL
参考答案:A
本题解析:
试题分析:酸式滴定管尖嘴处也盛有溶液,故溶液的体积大于40.00ml,答案选A.
考点:酸式滴定管
本题难度:一般
4、选择题 室温下,水的电离达到平衡:H2O═H++OH-.下列叙述正确的是( )
A.将水加热,平衡向正反应方向移动,Kw不变
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)
参考答案:B
本题解析:
本题难度:一般
5、选择题 室温时,将0.10 mol/L的NaOH溶液滴入20.0 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图。下列有关说法不正确的是
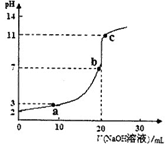
A.该一元酸溶液浓度为0.10mol/L
B.a、b、c点的水溶液导电性依次增强
C.室温时,HA的电离常数Ka l×10-5
l×10-5
D.a点和c点所示溶液中H2O的电离程度相同
参考答案:C
本题解析:
试题分析:A.NaOH、HA是一元碱、一元酸,当二者恰好完全反应时二者的物质的量相等,体积也相等,说明它们的浓度相等,该一元酸溶液浓度也相等,为0.10mol/L,正确;B.向弱酸溶液中加入强碱NaOH,发生中和反应产生盐,自由移动的离子浓度增大,溶液的导电性增强;当加入至酸完全反应时,自由移动离子进一步增多,离子浓度增大,溶液的导电性增强;后在加入NaOH,就相当与向盐NaA溶液中加入NaOH溶液。溶液中自由移动离子浓度增大,所以溶液的导电性比b点还强。故a、b、c点的水溶液导电性依次增强,正确;C.在未滴加NaOH溶液时,溶液的pH="2," c(H+)=10-2mol/L,NaOH是强碱,完全电离,当NaOH溶液滴入20ml时,恰好与酸HA完全反应,此时溶液的pH>7,说明得到的是强碱强弱酸盐,因此HA是弱酸,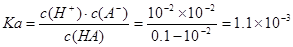 ,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
,错误;D.a点时酸过量,c(H+)=10-3mol/L, c点时碱过量,c(H+)=10-11mol/L,c(OH-)=Kw÷c(H+)=10-14÷10-11=10-3mol/L,所以二者对水的电离平衡的抑制作用相同,因此这两点所示溶液中H2O的电离程度相同,正确。
考点:考查电解质强弱的判断、物质浓度的计算及对水电离平衡的移动的影响的知识。
本题难度:困难