微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关晶体的说法中正确的是(???)
A.氯化钾溶于水时离子键未被破坏
B.金属晶体中金属键越强,熔点越高
C.冰融化时分子中共价键发生断裂
D.分子间作用力越大,分子越稳定
参考答案:B
本题解析:
试题分析:氯化钾溶于水时,电离出离子,离子键被破坏,A错误;冰融化是物理变化,破坏的是氢键,分子中共价键不变,C错误;分子间作用力只能影响物质的物理性质,但不会影响物质的稳定性,D错误,答案选B。
点评:该题是基础性试题的考查,侧重对教材基础知识的巩固和训练,意在培养学生灵活运用基础知识解决实际问题的能力,难度不大。
本题难度:简单
2、选择题 《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在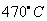 、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化
B.金刚石和石墨互为同位素
C.钠被氧化最终生成碳酸钠
D.金刚石属于原子晶体
参考答案:B
本题解析:
试题分析:有新物质生成的反应是化学反应,A正确;质子数相同而中子数不同的同一种元素的不同核素互为同位素,由同一种元素形成的不同单质,互称为同素异形体,所以金刚石和石墨互为同素异形体,B错误;CD都是正确的,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。
本题难度:一般
3、选择题 下列关系正确的是(??? )
A.离子半径:Cl->F->Al3+>Na+
B.熔点:石英>食盐>冰>干冰
C.结合H+能力: >
> >
>
D.热稳定性:PH3>H2S>HCl>HF
参考答案:B
本题解析:离子半径大小比较问题主要看两方面:①电子层数越多,半径越大。②电子层数相同时,再看核电荷数,核电荷数小的半径大,故A项不正确;B项涉及晶体熔点高低比较问题,一般:原子晶体>离子晶体>分子晶体。而金属晶体熔点差别较大,需具体问题具体分析;C项应为 >
> 本题难度:简单
本题难度:简单
4、选择题 NaF、NaI、MgO均为离子化合物,根据下列数据,这三种化合物的熔点高低顺序是:(??? )
物质
| ①NaF
| ②NaI
| ③MgO
|
离子电荷数
| 1
| 1
| 2
|
键长(10-10m)
| 2.31
| 3.18
| 2.10
A.①>②>③????? B. ③>①>②???? C. ③>②>①???? D. ②>①>③
参考答案:B
本题解析:构成离子晶体的离子键越强,物质的熔点越高。离子键强弱和形成离子键的离子半径以及离子所带电荷数有关系。离子半径越小、电荷数越多,离子键越强。所以正确的答案选B。
本题难度:一般
5、计算题 下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答:

(1)该化合物的化学式为?????????。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有??????个。
(3)设该化合物的式量为M,密度为ag/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为????????。
参考答案:(1) CaTiO3?(2)6? (3) 本题解析:(1)这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1;所以,该化合物的化学式为CaTiO3。 本题解析:(1)这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1;所以,该化合物的化学式为CaTiO3。
(2)钛位于立方体的顶点上,与一个钛离子距离最近的钛离子是与它共棱的。从上面立方晶胞进行堆积的图2和图3可以看出,在X轴或Y轴或Z轴上,与它共棱的离子都是二个,所
本题难度:一般
|