微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,水的离子积为Kw,该温度下将 a mol·L-1一元酸 HA 与b mol·L-1一元强碱BOH 等体积混合,若恰好完全中和,下列结论中不正确的是
A.混合液中:c(H+ ) ≤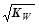
B.混合液中:c(HA)+c(A-)=a mol ·L-1
C.a = b
D.混合液中:c(H+ )+c(B+ )= c(OH-)+c(A- )
参考答案:B
本题解析:
试题分析:25℃时,a mol·L-1一元酸HA与bmol·L-1一元强碱BOH等体积混合后,可能是强酸和强碱反应,也可能是弱酸强碱,所以c(H+ ) ≤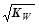 ;A选项正确,等体积混合,浓度应该减小一半,是
;A选项正确,等体积混合,浓度应该减小一半,是 本题难度:简单
本题难度:简单
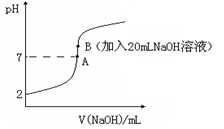
2、填空题 (14分)氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
已知:电离度(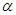 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[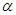 (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
a.升高温度???? b.向溶液中滴入2滴浓盐酸??? c.加入少量NaF固体??? d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__?????????????(保留两位有效数字),电离度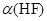 约为___????????????_%。
约为___????????????_%。
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(1)?? △H=-a kJ?mol -1;
??HF(aq)  ?H+(aq)+F-(aq)?? △H=+b kJ?mol -1
?H+(aq)+F-(aq)?? △H=+b kJ?mol -1
则该过程中和反应的热化学方程式为:________________________________??;在忽略F-水解的情况下,反应达到B点时,滴加过程中所释放的热量为________kJ(用只含a、b的式子表示)。
(4)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)="0.2" mol?L-1??
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)???
d.在A和B处溶液中都符合: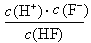 = Ka(HF)
= Ka(HF)
参考答案:(1) a? d(2分); a(2分)? (2) 5.3×1
本题解析:(1)电离是吸热的,所以a既能增大电离度,也能增大电离平衡常数。b是增大氢离子浓度,抑制电离,电离度减小,但电离平衡常数不变。C是增大氟离子浓度,抑制电离,电离度减小,但电离平衡常数不变。稀释促进电离,电离度增大,但电离平衡常数不变。所以答案分别选da和a。
(2)0.2mol?L-1的氢氟酸溶液中氢离子浓度是0.01mol/L,所以电离度是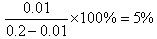 本题难度:一般
本题难度:一般
3、选择题 pH=l的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
①若a<4,则A、B?都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.
A.①④
B.②③
C.①③
D.②④
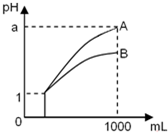
参考答案:C
本题解析:
本题难度:简单
4、选择题 将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是( )。
A.m<n
B.m>n
C.m=n
D.无法确定
参考答案:A
本题解析:盐酸为强酸,醋酸为弱酸,若将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积的相同倍数后,醋酸溶液的PH更小,若要使稀释后溶液的PH相同,则醋酸加水更多,即.m<n
本题难度:一般
5、选择题 NH3·H2O的电离平衡常数为Kb=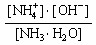 。氨水中各离子和分子的浓度大小关系为(???)
。氨水中各离子和分子的浓度大小关系为(???)
A.[NH4+]=[OH-]=[NH3·H2O]
B.[NH4+]>[OH-]>[NH3·H2O]
C.[NH4+]=[OH-]<[NH3·H2O]
D.[NH4+]<[OH-]<[NH3·H2O]
参考答案:D
本题解析:由于电离是微弱的,故[OH-]<[NH3·H2O],[NH4+]<[NH3·H2O],而其中还有水的电离,所以[NH4+]<[OH-]<[NH3·H2O]。
本题难度:简单