微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)某粗铜含铁、银、金和铂等杂质,通过电解精炼铜后,为充分利用电解后的阳极泥和电解液,设计如下工艺流程:
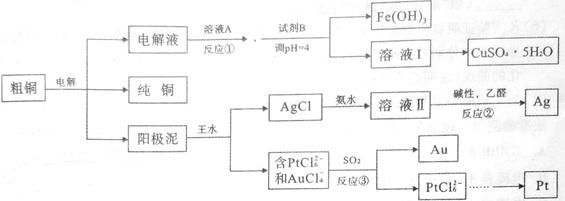
回答下列问题:
(1)电解时,以粗铜作______极,______________为电解液,写出阴极的电极反应式______________。
(2)电解后溶液中含有的主要金属阳离子为________________;溶液A是一种绿色氧化剂,则反应①的离子方程式为___________________________________________。
(3)加入的试剂B最好选用___________(填序号)
A.Cu
B.CuO
C.NaOH
D.氨水
(4)写出反应③的离子方程式______________________________________________________
(5)若反应②析出10.8kg银单质,则至少需要乙醛_________kg。
参考答案:(1)阳(1分) CuS
本题解析:
试题分析:粗铜含铁、银、金和铂等杂质在电解时铁先在阳极放电生成Fe2+,然后铜放电生成Cu2+,银、金和铂活泼性比铜弱,不放电,形成阳极泥。(1)精炼铜时粗铜做阳极,纯铜做阴极,电解质用CuSO4溶液;Cu2+在阴极放电,电极反应为:Cu2++ 2e-=Cu。(2)根据上述分析,电解液金属阳离子主要是Cu2+、Fe2+,绿色氧化剂通常是H2O2,氧化Fe2+,反应①的离子方程式为:2Fe2++ H2O2+ 2H+ =2Fe3++ 2H2O。(3)Fe2+被氧化后的溶液酸性较强,Fe3+难以形成沉淀,需要加入的试剂来使溶液的酸性减弱,为了不引入新的杂质最好加入CuO,加入Cu不反应不能起到降低酸性的作用,加入NaOH和氨水会引入新的杂质。(4)根据流程图,通入SO2后溶液中发生反应的是AuCl4-,生成了Au,元素的化合价发生改变,所以发生了氧化还原反应,SO2是还原剂,反应离子方程式为:2AuCl4-+ 3SO2+ 6H2O =2Au + 8Cl-+ 3SO42-+ 12H+(5)发生银镜反应乙醛与银的关系为:CH3CHO~2Ag,10.8kg银单质的物质的量为100mol,消耗CH3CHO为50mol,质量为:2.2 kg。
考点:铜的精炼、离子方程式的书写、化工流程题的解题方法。
本题难度:困难
2、选择题 铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。
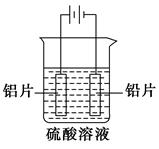
A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级
B.在电解过程中,H+向阳极移动,SO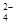 向阴极移动
向阴极移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+===2Al3++3H2↑
参考答案:C
本题解析:
试题分析:A、Al作电解池的阳极,Pb作电解池的阴极,则电子从阳极流出,流到正极,再从负极流回到阴极,错误;B、在电解过程中,阳离子移向阴极,阴离子移向阳极,错误;C、根据题意,Al极是氢氧根离子失去电子生成氧气,氧气与Al反应生成氧化铝,所以阳极区的氢氧根离子浓度减小,氢离子浓度增大,pH下降,正确;D、电池总反应中缺少通电的条件,错误,答案选C。
考点:考查电解原理的应用,电子、离子移动方向的判断
本题难度:一般
3、选择题 早在1807年化学家戴维用电解熔融氢氧化钠的方法制得钠:4NaOH(熔融) 4Na+O2↑+2H2O;后来盖—吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖—吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH(熔融) Fe3O4+2H2↑+4Na↑.下列有关说法正确的是? [???? ]
Fe3O4+2H2↑+4Na↑.下列有关说法正确的是? [???? ]
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-===H2↑+O2↑
B.盖-吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖-吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠,电解时可用石墨作阳极,铁作阴极
参考答案:D
本题解析:
本题难度:一般
4、填空题 如图甲、乙是电化学实验装置。
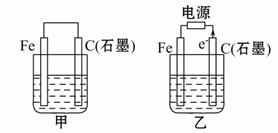
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为: ;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为: ;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
参考答案:(1)①O2+2H2O+4e-=4OH-
②2Cl-+
本题解析:(1)若两烧杯中均盛有饱和NaCl溶液,则:
①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-=4OH-。
②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应式为:Fe-2e-=Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×
2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×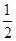 ×80 = 0.8(g),m(CuCO3)=0.02×
×80 = 0.8(g),m(CuCO3)=0.02×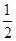 ×124=1.24(g)
×124=1.24(g)
本题难度:一般
5、选择题 某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是

A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动
B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是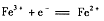
C.闭合K,断开K2,电流从石墨电极经过K.流向铁电极
D.闭合K,断开K2,左侧烧杯中的溶液pH将逐渐降低
参考答案:A
本题解析:
试题分析:闭合K2断开K1后,就形成的是一个电解池,根据电源的正极可知铁电极应该是阳极,是一个活性阳极,应该是铁失去电子,阳离子应该移动到阴极,故A的分析不合理;闭合K,断开K2,形成的是一个原电池,电子从负极出发到正极,铁失电子为负极,故电流方向从石墨电极经过K.流向铁电极,亚铁离子被空气中氧气氧化成铁离子,水解能力增强,故酸性增强,溶液pH将逐渐降低
考点:考查电化学的相关知识点
本题难度:困难