微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KN03→K20+5Na20+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0?L?N2(标准状况)
B.有0.250?mol?KN03被氧化
C.转移电子的物质的量为1.25?mol
D.被氧化的N原子的物质的量为3.75?mol
参考答案:C
本题解析:分析:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为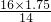 =2mol,以此来解答.
=2mol,以此来解答.
解答:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为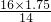 =2mol,
=2mol,
A.生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;
B.由反应可知,被还原的硝酸钾的物质的量为 =0.25mol,故B错误;
=0.25mol,故B错误;
C.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故C正确;
D.转移2mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为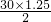 =18.75mol,故D错误;
=18.75mol,故D错误;
故选C.
点评:本题以信息的形式考查氧化还原反应,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,注意将N3-作为整体来分析是解答的难点.
本题难度:简单
2、选择题 铜和镁的合金4.6?g完全溶于浓硝酸,若反应中硝酸被还原只产生5.152L的NO2气体(已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02 g
B.8.51 g
C.8.26 g
D.7.04 g
参考答案:B
本题解析:
本题难度:困难
3、选择题 下列实验的前后,铜的质量一定发生变化的是
A.铜丝在空气中灼烧后立即插入乙醇
B.铜片放入酸化的硝酸钠溶液
C.铜和铁的混合物放入稀硝酸
D.铜、锌、稀硫酸构成的原电池放电
参考答案:B
本题解析:分析:A、铜灼烧生成了氧化铜,氧化铜和乙醇反应生成了乙醛和铜;
B、铜和稀硝酸反应生成了硝酸铜;
C、铁的还原性大于铜的还原性,铁先反应;
D、锌在原电池中作负极,被氧化,铜质量不变.
解答:A、由于氧化铜能够和乙醇反应生成乙醛和铜,铜变成氧化铜,氧化铜又被还原成铜,最终铜质量没有变化,故A错误;
B、铜和稀硝酸反应生成了硝酸铜,质量一定减少,故B正确;
C、由于铁还原性大于铜的,铁先参加反应,若是铁足量,铜变化消耗,故C错误;
D、铜、锌构成的原电池,锌是负极,铜是正极不消耗,故D错误;
故选B.
点评:本题考查了铜的化学性质,涉及了原电池的知识,联系所学知识能够完成,本题难度中等,
本题难度:困难
4、选择题 向600mL?0.5?mol·L-1的硫酸溶液一定量的中加入Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.6.4g
B.4.8g
C.2.4g
D.1.6g
参考答案:B
本题解析:设Fe2O3、Cu的物质的量分别是x和y,则根据反应式3H2SO4+Fe2O3=3H2O+Fe2(SO4)3、Fe2(SO4)3+Cu=2FeSO4+CuSO4可知,x=y,消耗硫酸是3x,所以x=0.1mol,则混合物中氧元素的质量是3x×16g/mol=4.8g,则固体减少的质量就是4.8g,答案选B。
本题难度:一般
5、选择题 为了检验溶液中是否含有Fe3+,可向溶液中加入
A.NaCl溶液
B.铁片
C.KSCN溶液
D.石蕊溶液
参考答案:C
本题解析:滴加KSCN溶液,溶液变为血红色,证明含Fe3+,这是检验Fe3+的特征反应
本题难度:困难