微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将20mL0.4mol·L-1硝酸铵溶液跟50mL0.1mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是???( ??????)
A.c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
参考答案:B
本题解析:对混合溶液,所有离子在溶液中有相同的体积,因此,比较它们的浓度大小,只需要比较它们的物质的量即可.溶液混合后,离子之间能够发生反应的是铵根离子(NH4+)与氢氧根离子(OH-)之间,根据它们之间物质的量的关系(8mmol<毫摩尔>:10mmol<毫摩尔> ),反应后OH-有剩余,可以得到c(OH-)>c(NH4+),其余离子之间的关系容易得到。
本题难度:一般
2、选择题 下列有关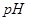 变化的判断中,错误的是
变化的判断中,错误的是
A.随着温度的升高,醋酸溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH减小
参考答案:B
本题解析:PH值是以H+为计算依据来进行计算的。
A正确,温度升高,对弱酸来讲,平衡朝电离方向进行,氢离子浓度增加,PH值减小。
B错误,升高温度,促进电离,纯水的PH减小。
C正确,氯水放在光照的条件下,一段时间后,HClO分解变成HCl,溶液酸性增强,PH减小。
D正确,氢氧化钠溶液久置于空气中变质,部分变成碳酸钠,碱性减弱,PH值减小。
本题难度:一般
3、选择题 常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,滴定曲线如右图。下列说法正确的是
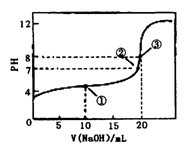
A.点①所示溶液中:[CH3COO-]+[OH-]=[CH3COOH] +[H+]
B.点②所示溶液中:[Na+]=[CH3COOH]+[CH3COO-]
C.点③所示溶液中:[Na+]>[OH-]>[CH3COO-]>[H+]
D.滴定过程中可能出现:[CH3COOH]>[CH3COO-]>
[H+]>[Na+」>[OH-]
参考答案:D
本题解析:A 错误,应遵循电荷守恒,[CH3COO-]+[OH-]=[Na+]+[H+]
B 错误,点②所示溶液PH=7,显中性,[Na+]=[CH3COO-]
C 错误,点③所示溶液中:[Na+]>[CH3COO-]>[OH-]>[H+]
D 正确。在CH3COOH溶液中开始滴入很少量的NaOH溶液时出现此种情况。
本题难度:一般
4、选择题 甲醇属于可再生能源,可代替汽油作为汽车燃料。下列热化学方程式中的反应热能正确表示甲醇燃烧热的是[???? ]
A.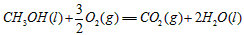
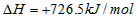
B.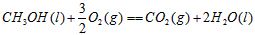
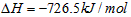
C.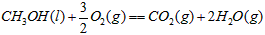 ?
?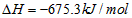
D.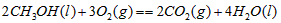 ?
?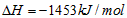
参考答案:B
本题解析:
本题难度:简单
5、选择题 25℃时,在0.01mol/L的氢氧化钡溶液中,由水电离出的c(OH-)浓度是
A.0.02mol/L
B.5×10-13mol/L
C.1×10-7mol/L
D.1×10-12mol/L
参考答案:B
本题解析:
试题分析:氢氧化钡是二元强碱,抑制水的电离。溶液中OH-的浓度是0.02mol/L,则溶液中氢离子的浓度是5×10-13mol/L,所以由水电离出的OH-的浓度就是1×10-12mol/L,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重考查学生的灵活应变能力。该题的关键是明确碱溶液中水电离出的OH-的浓度就等于溶液中氢离子的,然后结合题意列式计算即可。
本题难度:简单