微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知AgCl、AgBr的溶解度分别为1.5×10-4g、8.4×10-6 g(20℃)。将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )。
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl沉淀少于AgBr沉淀
D.AgCl沉淀多于AgBr沉淀
参考答案:D
本题解析:
试题分析:由AgCl、AgBr的溶解度可知,氯化银的溶解度大于溴化银的溶解度,所以AgCl与AgBr的饱和溶液中氯离子的浓度大于溴离子的浓度,等体积混合后,先是氯化银沉淀转化为溴化银沉淀,而原溶液中氯离子的物质的量大于溴离子的物质的量,再加入足量的硝酸银溶液,二者都会沉淀,但生成的氯化银沉淀多于溴化银,答案选D。
考点:考查难溶电解质的溶解平衡的判断
本题难度:一般
2、填空题 (普通班)(15分)已知常温下,AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17.
(1)AgBr固体在水中达到溶解平衡,写出其表达式 ;此时溶液中c(Ag+)= mol/L;
(2)现向AgBr的悬浊液中:①加入AgNO3固体,则c(Br -) (填“变大”、“变小”或“不变”,下同);②若改加更多的AgBr固体,则c(Ag+) ;
③若改加更多的KI固体,则c(Ag+) ,c(Br -) 。
(3)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是( )
A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
参考答案:18.(普通班) (15分)
(1)AgBr(s) <
本题解析:
试题分析:(1)AgBr固体在水中达到溶解平衡,表达式为AgBr(s) Ag+(aq)+Br-(aq),根据[Ag+]? [Br-]=4.9×10-13,解得c(Ag+)= 7×10-7 mol/L (2)AgBr(s)
Ag+(aq)+Br-(aq),根据[Ag+]? [Br-]=4.9×10-13,解得c(Ag+)= 7×10-7 mol/L (2)AgBr(s) Ag+(aq)+Br-(aq),加入AgNO3 固体,导致[Ag+]增大,平衡左移,则c(Br -)变小;若改加更多的AgBr固体,因为原溶液为饱和溶液,所以浓度不变,平衡不移动,c(Ag+)不变,若改加更多的KI固体,根据AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17 AgI更难溶,沉淀发生转化,c(Ag+)变小,c(Br -)变大。(3)将难溶电解质放入纯水中, 溶解达到平衡时,电解质离子的浓度的系数次幂的乘积就是该物质的溶度积,A错误;两种难溶盐电解质,只有化学式组成相同,才能根据Ksp小的溶解度也一定小判断,B错误;难溶盐电解质的Ksp与温度有关,C正确;向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,因为温度不变,AgCl的Ksp不变,其溶解度也不变,D正确;
Ag+(aq)+Br-(aq),加入AgNO3 固体,导致[Ag+]增大,平衡左移,则c(Br -)变小;若改加更多的AgBr固体,因为原溶液为饱和溶液,所以浓度不变,平衡不移动,c(Ag+)不变,若改加更多的KI固体,根据AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17 AgI更难溶,沉淀发生转化,c(Ag+)变小,c(Br -)变大。(3)将难溶电解质放入纯水中, 溶解达到平衡时,电解质离子的浓度的系数次幂的乘积就是该物质的溶度积,A错误;两种难溶盐电解质,只有化学式组成相同,才能根据Ksp小的溶解度也一定小判断,B错误;难溶盐电解质的Ksp与温度有关,C正确;向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,因为温度不变,AgCl的Ksp不变,其溶解度也不变,D正确;
考点:考查难溶电解质的沉淀溶解平衡,平衡的移动等知识。
本题难度:困难
3、选择题 在溶液中有浓度均为0.01 mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39;
Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2] =1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11。当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小 [???? ]
A. Fe3+
B. Cr3+
C. Zn2+
D. Mg2+
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是(??)
A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S=CuS↓+2H+
C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑
D.FeS+2H+=Fe2++H2S↑
参考答案:C
本题解析:因为MgCO3的溶解度大于Mg(OH)2的,所以会形成Mg(OH)2,A正确;H2S电离生成S2-的能力大于CuS的,小于FeS的,所以H2S与Cu2+反应生成更难电离的CuS,FeS与H+反应生成更难电离的H2S,B、D正确;依溶解度Zn(OH)2>ZnS,可知应该生成难溶的ZnS,C错误。
本题难度:简单
5、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
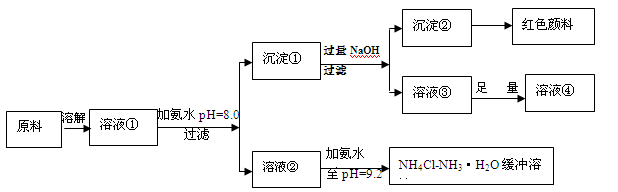
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
参考答案:(1)大 &#
本题解析:
试题分析:(1)pH相同的氨水和烧碱,氨水的物质的量浓度大,所以需要的酸的体积大。(2) 溶液的pH=8,氢离子浓度=10-8mol/L,氢氧根离子浓度=10-6mol/L,根据Ksp[Fe(OH)3]=4.0×10-38计算铁离子浓度=4.0×10-20。
(3)缓冲溶液中有铵根离子,所以存在铵根离子的水解平衡,NH4++H2O NH3·H2O+H+,溶液中有一水合氨,NH3·H2O
NH3·H2O+H+,溶液中有一水合氨,NH3·H2O NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O
NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s)
H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
考点:盐类的水解。
本题难度:困难