微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学——选修2:化学与技术】(15分)
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

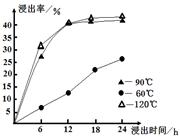
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
参考答案:(除标记外每空2分,共15分)
(1)12
本题解析:
试题分析:(1)根据五行可知,温度太低浸出率较低,而90℃与120℃时的浸出率差不太多,而温度太高消耗的能量较多,生产成本大,所以最佳的温度是90℃,12小时时浸出率基本达到最大,再增长时间,浸出率增大不多,所以最佳的浸出时间是12小时;
(2)该反应不是氧化还原反应,所以只需按照质量守恒定律配平即可,Fe元素守恒,则硫酸铁的系数是3,Na2Fe6(SO4)4(OH)12的系数是1,则硫酸钠的系数是5,所以碳酸钠的系数是6,二氧化碳为6,水是6;
(3)加入过量NaF溶液,则生成MgF2和CaF2沉淀,则滤液为二者的饱和溶液,溶液中的氟离子浓度相等,所以滤液中的c(Ca2+)/c(Mg2+)= KSP(CaF2)/ KSP(MgF2)= 1.11×10-10/7.4×10-11=1.5;
(4)根据流程图分析,除铁、钙、镁的过程中都生成硫酸钠,加入草酸铵后生成草酸钴沉淀,则该沉淀中可能存在的杂质离子有SO42-、NH4+、Na+;将得到的沉淀洗涤以除去杂质离子,然后低温干燥,防止草酸钴分解;
(5)充电时,Li+还原为Li,则LiCoO2中Li的化合价是+1价,所以LiC6中Li的化合价Li的化合价是0价;放电时正极发生还原反应,则CoO2得到1个电子与锂离子结合为LiCoO2,所以放电时有1mole-转移,则有1mol LiCoO2生成,正极CoO2增加的质量即为1molLi的质量为7g。
考点:考查对图像的分析判断,化学方程式的配平,溶度积的应用,电化学反应原理的应用
本题难度:困难
2、选择题 一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。25 ℃时,在AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质
| AgCl
| AgI
| Ag2S
|
颜色
| 白
| 黄
| 黑
|
Ksp(25 ℃)
| 1.8×10-10
| 1.5×10-16
| 1.8×10-50
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
参考答案:C
本题解析:由于在25 ℃时AgCl、AgI、Ag2S的溶度积常数不同,在各饱和溶液中Ag+的浓度分别为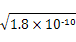 ?mol/L、 ?mol/L、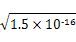 ?mol ?mol
本题难度:一般
3、选择题 相同温度下,将足量的AgCl分别放入下列溶液中:
①20mL0.1mol/L(NH4)2CO3溶液 ②40mL0.02 mol/LBaCl2溶液
③40mL0.03 mol/L盐酸 ④10 mL蒸馏水
⑤50 mL0.05mol/LAgNO3溶液。则AgCl的溶解度大小顺序为:
A.①=②=③=④=⑤
B.①>④>③>②>⑤
C.⑤>④>①>③>②
D.④>③>⑤>①>②
参考答案:B
本题解析:①(NH4)2CO3水解产生的NH3·H2O与Ag+ ?形成络合物,促进溶解;②③中③的Cl―浓度小,溶解得多,④正常溶解⑤Ag+浓度大,溶解的量最少;选B。
本题难度:一般
4、选择题 当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是.(???)
A.AgI比AgCl稳定
B.氯的非金属性比碘强
C.I-的还原性比Cl-强
D.AgI的溶解度比AgCl小
参考答案:D
本题解析:
试题分析:由于沉淀转化的方向一般是向生成更难溶的方向进行,所以根据部分AgCl转化为AgI可知,碘化银的溶解度小于氯化银的溶解度,因此答案选D。
点评:沉淀转化的实质实际上是溶解平衡的应用,即由于改变了某离子的浓度,破坏了溶解平衡,从而达到新的平衡状态。利用溶解平衡,可以使反应向我们希望的方向进行。
本题难度:一般
5、选择题 某温度下,在100ml饱和石灰水中加入少量生石灰,充分反应后恢复到原来的温度。下列判断正确的是 [???? ]
A. 溶液中Ca2+数目减少
B. 溶液中c(Ca2+)增大
C. 溶液的pH不变
D. 溶液中溶质的质量分数增大
参考答案:AC
本题解析:
本题难度:一般
|