微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列情况下的反应一定能自发进行的是( ? )
A.△H>0△S<0
B.△H>0△S>0
C.△H<0△S<0
D.△H<0△S>0
参考答案:D
本题解析:
本题难度:简单
2、选择题 某反应:A B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
A.△H>0、△S>0
B.△H>0、△S<0
C.△H<0、△S>0
D.△H<0、△S<0
参考答案:A
本题解析:
试题分析:根据△G=△H-T·△S可知,只要△G小于0,反应就一定是自发进行的。由于该反应在室温下不能自发进行,在高温下能自发进行,这说明该反应的△H>0、△S>0,答案选A。
考点:考查反应自发性的判断
点评:该题是基础性试题的考查,试题基础性强,旨在考查学生灵活运用△G=△H-T·△S解决实际问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确反应自发性的判断依据,并能灵活运用即可。
本题难度:一般
3、选择题 在一密闭容器中进行反应:X2+3Y2?2Z2,若X2、Y2、Z2的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡状态时,下列物质的浓度可能为( )
A.X2为0.2mol/L
B.Y2为0.2mol/L
C.Z2为0.4mol/L
D.Y2为0.6mol/L
参考答案:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.ΔH>0,ΔS>0的反应任何条件都是非自发反应;
B.因N2(g)+3H2(g)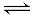 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
C.一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)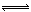 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态
2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态
D.H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(g) △H=-571.6 kJ·mol-1
参考答案:B
本题解析:
试题分析:△G=△H-T△S,对于ΔH>0、ΔS>0的反应当温度达到一定高时才能使△G<0,故ΔH>0,ΔS>0的反应并不能任何条件都是非自发反应,故A项错误;由反应N2(g)+3H2(g)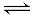 2NH3(g)△H=-d kJ/mol可知当有1 mol N2与3 mol H2完全反应时放出热量为d kJ,但在某容器中投入1 mol N2与3 mol H2,由于反应为可逆反应,故1 mol N2与3 mol H2不会完全反应,故放出热量小于d kJ,则B项正确;同一化学反应各物质的速率之比等于化学计量数之比,故一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)
2NH3(g)△H=-d kJ/mol可知当有1 mol N2与3 mol H2完全反应时放出热量为d kJ,但在某容器中投入1 mol N2与3 mol H2,由于反应为可逆反应,故1 mol N2与3 mol H2不会完全反应,故放出热量小于d kJ,则B项正确;同一化学反应各物质的速率之比等于化学计量数之比,故一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)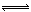 2SO3(g) △H<0,当v正(SO2)= 2v逆(SO3)时,该反应已达到平衡状态,故C项错误;燃烧热为1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,故H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ·mol-1,故D项错误;本题选B。
2SO3(g) △H<0,当v正(SO2)= 2v逆(SO3)时,该反应已达到平衡状态,故C项错误;燃烧热为1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,故H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ·mol-1,故D项错误;本题选B。
考点:化学反应能量变化。
本题难度:一般
5、选择题 已知298 K下反应2Al2O3(s)+3C(s)===4Al(s)+3CO2(g) ΔH=+2 171 kJ/mol,ΔS=+635.5 J/(mol·K),则下列说法正确的是 ( )
A.由题给ΔH值可知,该反应是一个放热反应
B.ΔS>0表明该反应是一个熵增加的反应
C.该反应能自发进行
D.不能确定该反应能否自发进行
参考答案:B
本题解析:根据方程式可知,这是一个熵值增加的、吸热的反应,所以选项A不正确,B正确。根据△G=△H-T·△S可知,反应能否自发还需要根据温度确定,根据题意可知,该反应在高温下是可以自发的,CD都是错误的,答案选B。
本题难度:简单