微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各图所表示的反应是吸热反应的是
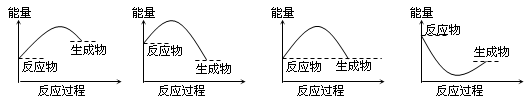
A B C D
参考答案:A
本题解析:某一反应是放热反应还是吸热反应取决于反应物和生成物所具的总能量相对大小;若反应物的总能量大于生成物的总能量,则该反应为放热反应;若反应物的总能量小于生成物的总能量,则该反应为吸热反应;正确选项选项为A;
本题难度:一般
2、填空题 当铁丝加热后放入氧气中可观察到___________现象。说明这个反应是___________反应(填“吸热”或“放热”),说明铁单质的稳定性___________(填“强”或“弱”)。
参考答案:火星四射,有黑色物质生成?放热?弱
本题解析:该题是通过现象判断放热、吸热反应。
本题难度:简单
3、填空题 (16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3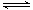 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7
HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7
HCO3-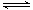 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11
CO32-+ H+ Ka2(H2CO3) = 5.61×10-11
HClO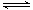 H++ ClO- Ka(HClO) = 2.95×10-8
H++ ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。
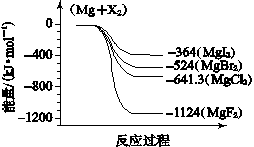
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式 。
参考答案:(1)Cl2+H2O 本题解析:
本题解析:
试题分析:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O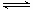 H++Cl-+HClO;
H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O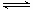 HCl+HClO
HCl+HClO
起始浓度:0.09 0 0
转化浓度:0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03
则K=(0.03×0.03)÷0.06=0.015mol/L;
(3)在上述平衡体系中加入少量NaCl固体,增大溶液中的氯离子离子,平衡向逆反应方向进行;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,即平衡向正反应方向移动,氯气的溶解量会增加;
(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,但次氯酸的酸性强于碳酸氢根离子的,则将少量的氯气通入到过量的碳酸钠溶液中生成氯化钠、次氯酸钠和碳酸氢钠,离子方程式为Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-。
(6)A、相同类型的离子晶体中,离子键越大,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力,故正确;B、根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;C、能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故错误;D、⑤Mg(s)+F2(l)=MgF2(s)△H-1124kJ/mol,Mg(s)+Br2(l)MgBr2(s)△H-524kJ/mol,将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)MgBr2(s)+F2(g);△H+600kJ?mol-1,故正确;答案为ABD。Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l)△H=-117KJ?mol-1。
考点:考查平衡常数计算与应用、外界条件对平衡状态的影响;物质结构与性质以及盖斯定律的应用等
本题难度:困难
4、选择题 下列物质只含有离子键的是(?????)
A.CO2
B.NaOH
C.MgCl2
D.H2O
参考答案:C
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。所以选项A~D中含有的化学键依次是极性键、离子键和极性键、离子键、极性键。答案选C。
本题难度:一般
5、选择题 下列说法不正确的是
A.在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器
B.铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂及催化剂载体
C.使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容
D.铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒
参考答案:D
本题解析:
试题分析:A项在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器,A项正确;B项铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等,故B项正确;C项“绿色化学”由美国化学会(ACS)提出,目前得到世界广泛的响应。其核心是利用化学原理从源头上减少和消除工业生产对环境的污染;反应物的原子全部转化为期望的最终产物,故使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容,C项正确;D.铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的净化处理,但不能用于饮用水的杀菌消毒,故D项错误;本题选D。
考点:化学与生产生活。
本题难度:一般