微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有水参加的化学反应中,不属于水解反应的是( ? )
A.NH3+H2O?NH4++OH-
B.HCO3-+H2O?H2CO3+OH-
C.Al3++3H2O?Al(OH)3+3H+
D.NH4++2H2O?NH3?H2O+H3O+
参考答案:A
本题解析:
本题难度:一般
2、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
参考答案:C
本题解析:
试题分析:A、pH=4的醋酸中:c(H+)=10—4mol·L-1,错误;B、根据物料守恒知,饱和小苏打溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),错误;C、根据电荷守恒知,饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、50℃时Kw>1×10-14,pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol?L-1,错误。
考点:考查pH计算、溶液中离子浓度大小关系。
本题难度:一般
3、简答题 现有下列5种有机物:①甲苯、②乙醛、③乙酸乙酯、④苯酚、⑤乙烯.
(1)上述物质中能发生水解反应的是(填序号,下同)______;能发生银镜反应的是______;属于聚合物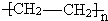 的单体是______.
的单体是______.
(2)上述物质有1种能与浓溴水反应产生白色沉淀,写出反应的化学方程式______.
参考答案:(1)③乙酸乙酯含有酯基,能发生水解反应;②乙醛含有醛基,能
本题解析:
本题难度:简单
4、填空题 (16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图
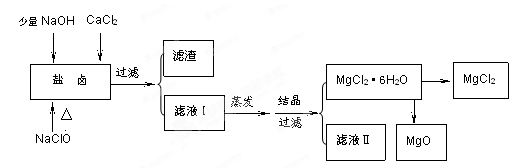
(1)滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。
(2) 加入NaClO的作用是 。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。

请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式 ;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是 。
参考答案:(1)Na+
(2)将Fe2+ 氧化为 Fe3+ ,并
本题解析:
(1)滤渣的成分是Fe(OH)3;滤液Ⅱ中所含的主要杂质离子是Na+。 (2)加入NaClO还能起到的作用是氧化Fe2+使它变成Fe(OH)3沉淀而除去。 (3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是MgCl2·6H2O MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。
MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中为抑制上述反应,所需要的化学试剂是HCl气体。
① Mg(OH)Cl  MgO + HCl↑②P(HCl)小,加热时Mg2+ 会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
MgO + HCl↑②P(HCl)小,加热时Mg2+ 会发生水解;通入HCl,增大P(HCl,抑制 Mg2+水解。
本题难度:一般
5、填空题 (12分)(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因: 。
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) 。
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): 。
参考答案:(1)1×10-12 &#
本题解析:
试题分析:(1)酸、碱抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。
(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O CH3COOH +OH-,
CH3COOH +OH-,
②在CH3COONa 溶液中,CH3COO-因水解而减少,该溶液因水解显碱性,则按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(3)FeCl3的水溶液中,由于Fe3+的水解,导致溶液呈酸性,离子方程式为Fe3++3H2O  Fe(OH)3+3H+ .
Fe(OH)3+3H+ .
考点:考查影响水电离平衡的因素,盐类水解的应用等知识。
本题难度:一般