微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是????? ( )
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:醋酸溶液存在如下电离平衡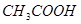 ?
? ;加水稀释,平衡向右移动,所以
;加水稀释,平衡向右移动,所以
A错,加水稀释,溶液中的c(CH3C
本题难度:一般
2、填空题 (12分)某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗NaOH溶液的体积(mL)
| 25.05
| 25.00
| 23.80
| 24.95
则该醋酸溶液的浓度为________________。
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。

①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为 。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的 倍;
c (OH-) -c (CH3COOH) = mol·L-1。
参考答案:(1)250mL容量瓶(2分,写容量瓶不给分)胶头滴管(2分
本题解析:
试题分析:(2)配置一定物质的量浓度的溶液值一定要用到容量瓶,溶液需要250mL,故选用250mL容量瓶来,在定容的时候还要用到胶头滴管。(2)在四组数据中第3组相差太大,要舍去,消耗NaOH溶液的体积为:(22.05+25.00+24.95)÷3="25.00" mol,根据c(NaOH)×V(NaOH)=c(CH3COOH)×V(CH3COOH),0.2000 mol·L-1×25.00 mol= c(CH3COOH)×25.00 mL,得c(CH3COOH)=0.2000mol·L-1。(3)①滴加12.50mLNaOH时CH3COOH没有完全反应,CH3COOH过量,溶液显酸性,离子浓度大小顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。②当滴加25.00mLNaOH时CH3COOH完全反应,生成CH3COONa,CH3COO-水解使得溶液显碱性,pH=9时c(H+)=10-9mol·L-1,则c(OH-)=10-5mol·L-1,此时的OH-都是由水电离出来的,纯水电离的c(OH-)=10-7mol·L-1,是纯水电离程度的100倍。根据电荷守恒和物料守恒有c (OH-) +c (CH3COO-) =c(H+)+ c(Na+),c(Na+)= c(CH3COO-)+ c(CH3COO-),则有c (OH-) -c (CH3COOH)=c(OH-)=10-9mol·L-1
考点:溶液的配制、离子浓度的浓度大小比较和离子浓度的计算。
本题难度:困难
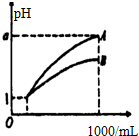
3、选择题 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
参考答案:AB
本题解析:
本题难度:一般
4、选择题 在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
A.20mL水
B.浓盐酸
C.冰醋酸
D.NaOH溶液
参考答案:B
本题解析:
试题分析:醋酸电离方程式为:CH3COOH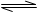 CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后 CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后
PH降低,H+浓度增大,平衡向逆反应方向移动。C选项,加入冰醋酸,PH减小,但平衡向正反应方
向移动。
本题难度:一般
5、选择题 证明氨水是弱碱的事实是(???)
A.氨水与硫酸发生中和反应
B.氨水能使紫色石蕊液变蓝
C.0.1 mol/L的NH4Cl溶液的pH值为5.1
D.铵盐与熟石灰反应逸出氨气
参考答案:C
本题解析:略
本题难度:简单
|