微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于盐酸与醋酸两种稀溶液的说法正确的是[???? ]
A.相同浓度的两溶液中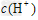 相同
相同
B.100mL?0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,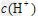 均明显减小
均明显减小
参考答案:B
本题解析:
本题难度:一般
2、实验题 某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
温度(℃)
| 10
| 20
| 30
| 50
| 70
| 80
| 100
|
pH
| 8.3
| 8.4
| 8.5
| 8.9
| 9.4
| 9.6
| 10.1
?
实验2:10℃时,在烧杯中加入0.1mol/LNaHCO3溶液200mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8。
实验3:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊。
实验4:
①配制0.1mol/LNaHCO3溶液和0.1mol/LNa2CO3溶液各200mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5。
②加热蒸发0.1mol/L NaHCO3溶液200mL,至溶液体积100mL,停止加热,加水至200mL,冷却至原温度,测得溶液pH=9.8。
③将0.1mol/L NaHCO3溶液200mL敞口放置三天,再加水至200mL,测得溶液pH=10.1。
请根据上述实验回答下列问题:
(1)用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)___________
________________、_______________________________。这两个平衡以_______________
为主,理由是_______________________________.
(1)实验3得到的结论是__________________________________________________。
(1)结合实验2、3分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是_____________
__________、______________________、________________________________。
(1)实验4①得到的结论是_______________________________________________。
(1)实验4②“加水至200mL”的目的是____________________________________________。
实验4③可以得到的结论是_______________________________________。
(1)要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________________。
参考答案:(本题共12分,每空1分)
(1) 本题解析: 本题解析:
试题分析:(1)NaHCO3为弱酸酸式盐,可发生电离,也发生水解反应,根据实验1表中数据可知NaHCO3溶液呈碱性,所以以水解为主。
(2)加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊,说明生成的气体为CO2。
(3)实验2温度升高,溶液的pH增大,说明加热促进了NaHCO3的水解,实验三生成了CO2,可能为NaHCO3发生了分解反应。
(4)Na2CO3溶液的pH大,说明Na2CO3溶液的碱性强,水解程度大。
(5)加水至200mL,与原溶
本题难度:困难
3、选择题 常温下, 某一元酸(HA)溶液中 某一元酸(HA)溶液中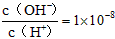 ,下列叙述正确的是[???? ] ,下列叙述正确的是[???? ]
A.该溶液中由水电离出的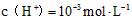
B.该溶液中
C.该溶液与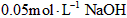 溶液等体积混合后所得溶液中 溶液等体积混合后所得溶液中
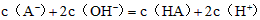 ? ?
D.向该溶液中加入一定量的水,溶液中离子的浓度均减小
参考答案:C
本题解析:
本题难度:一般
4、填空题 完成下列物质的电离方程式(1)NaHSO4 (2)NaHSO3 (3)NaH2PO4
参考答案:(1)NaHSO4 =Na++H++SO42-(2)NaHS
本题解析:
试题分析:此题应注意弱酸的不完全电离,各物质的电离方程式为(1)NaHSO4 =Na++H++SO42-(2)NaHSO3=Na++H++SO32-(3)NaH2PO4=Na++H2PO4-
点评:该题是基础性试题的考查,难度不大,但是要注意HSO4-要拆出来,HSO3-和
H2PO4-不能拆出来。
本题难度:简单
5、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A pH=4的醋酸中:c(H+)=4.0molL-1
B 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
参考答案:D
本题解析:A中c(H+)=10-4mol/L,不是4mol/L,A错;HCO3-+H2O H2CO3-+OH-、HCO3- H2CO3-+OH-、HCO3- CO CO
本题难度:一般
|