微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是(???)
①将水加热煮沸????②向水中投入一小块金属钠??③向水中通CO2
④向水中通NH3????⑤向水中加入明矾晶体??????⑥向水中加入NaHCO3固体
⑦向水中加NaHSO4固体
A.①③⑥⑦
B.①③⑤⑥
C.⑤⑦
D.⑤
参考答案:D
本题解析:大量吸热,所以升高温度,促进电离,但纯水仍然显中性。钠溶于水生成氢氧化钠,增大OH-的浓度,抑制水的电离。同样③④⑦的水溶液均电离出氢离子或OH-,抑制水的电离。⑤⑥属于盐类的水解,促进电离,其中⑤水解显酸性,⑥水解显碱性,所以答案选D。
本题难度:一般
2、计算题 (8分) 25℃时,若体积为Va、pH=a 的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va>Vb和a=0.5b。则:
(1) a值可否等于3 (填“可”或“否”)??,其理由是????????????????????????????????。
(2) a值可否等于5(填“可”或“否”)??,其理由是?????????????????????????????????。
(3)a 的取值范围????????????????????????????。
参考答案:)(1)否,a=0.5b时,若a=3,b=6,不合题意;
本题解析:考查溶液pH计算。
(1)若a=3,则b=6,25℃是碱溶液的pH应该是大于7的,所以a不可能等于3。
(2)若a=5,则b=10,强酸中c(H+)=10-5 ?mol·L-1,强碱中c(OH-)=10-4? mol·L-1,根据恰好中和可得10-5 mol·L-1Va=10-4 mol·L-1Vb,Va / Vb=10>1,所以符合条件。
(3)由于b<14,所以a<7。因为恰好反应,所以10-a mol·L-1Va=10b-14 mol·L-1Vb,解得Va / Vb=![]()
本题难度:一般
3、选择题 下列说法正确的是
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
参考答案:C
本题解析:本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题
本题难度:简单
4、填空题 (9分)(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。
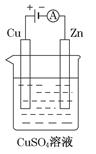
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
参考答案:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)
本题解析:
试题分析:(1)1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),则1molN2H4即32g在氧气中完全燃烧生成氮气和H2O,放出19.5kJ×32=624 kJ热量,因此表示N2H4燃烧热的热化学方程式是N2H4(l)+O2(g)=N2(g)+2H2O(l) ΔH=-624 kJ·mol-1。
(2)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应,因此该原电池中正极反应式为O2+2H2O+4e-=4OH-,负极是肼失去电子,电极反应式为N2H4+4OH--4e-=4H2O+N2↑。
(3)①锌与电源的负极相连,作阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
②铜片质量变化为128g,即电解128g铜时失去电子的物质的量是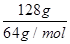 ×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
×2=4mol,因此根据电子得失守恒可知消耗氧气的物质的量是1mol,在标准状况下的体积是22.4L,所以需要空气的体积是22.4L×5=112L。
考点:考查热化学方程式书写以及电化学原理的应用
本题难度:一般
5、选择题 下列热化学方程式中,△H能正确表示物质的燃烧热的是
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0kJ/mol
B.C(s) +1/2O2(g) ==CO(g); △H=-110.5kJ/mol
C.H2(g) +1/2O2(g)==H2O(g); △H=-241.8kJ/mol
D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036kJ/mol
参考答案:A
本题解析:在选择项中A B C 中虽然燃烧物都是一摩尔,但CO(g)和H2O(g)都不是稳定态,所以都错,A正确,D中是2摩尔C8H18(l)所以错误很明显。故选A。
考点:燃烧热
点评:在燃烧热的概念中有几个需要特别注意的点:1mol物质,完全燃烧,生成物是稳定的化合物。
本题难度:困难